पाठ – 1
रासायनिक अभिक्रियाएँ एवं समीकरण
In this post we have given the detailed notes of class 10 Science chapter 1 Chemical Reactions and Equations in Hindi. These notes are useful for the students who are going to appear in class 10 board exams.
इस पोस्ट में कक्षा 10 के विज्ञान के पाठ 1 रासायनिक अभिक्रियाएँ एवं समीकरण के नोट्स दिये गए है। यह उन सभी विद्यार्थियों के लिए आवश्यक है जो इस वर्ष कक्षा 10 में है एवं विज्ञान विषय पढ़ रहे है।
| Board | CBSE Board, UP Board, JAC Board, Bihar Board, HBSE Board, UBSE Board, PSEB Board, RBSE Board, CGBSE Board, MPBSE Board |
| Textbook | NCERT |
| Class | Class 10 |
| Subject | Science |
| Chapter no. | Chapter 1 |
| Chapter Name | रासायनिक अभिक्रियाएँ एवं समीकरण (Chemical Reactions and Equations) |
| Category | Class 10 Science Notes in Hindi |
| Medium | Hindi |
Chapter – 1 रासायनिक अभिक्रियाएँ एवं समीकरण
रासायनिक अभिक्रिया
- रासायनिक अभिक्रिया क्या है :- किसी किसी भी पदार्थ में जब परिवर्तन होता है तो तो यह है दो प्रकार का परिवर्तन होता है। पहला भौतिक परिवर्तन जिसमें पदार्थ के परिवर्तन के पश्चात पदार्थ को वापस उसी अवस्था में लाया जा सकता है। तथा दूसरा रासायनिक परिवर्तन जिसमें पदार्थ को रासायनिक गुणों में परिवर्तन किया जाता है। इसमें पदार्थ को वापस उसी अवस्था में प्राप्त नहीं किया जा सकता है।
- रासायनिक अभिक्रिया में एक या अधिक पदार्थ आपस में अन्तर्क्रिया (इन्टरैक्शन) करके परिवर्तित होते हैं और एक या अधिक भिन्न रासायनिक गुण वाले पदार्थ बनते हैं। किसी रासायनिक अभिक्रिया में भाग लेने वाले पदार्थों को अभिकारक (रिएक्टैन्ट्स) कहते हैं। अभिक्रिया के फलस्वरूप उत्पन्न पदार्थों को उत्पाद (प्रोडक्ट्स) कहते हैं।
2H2 + O2 → 2H2O

- (यहाँ हाइड्रोजन और ऑक्सीजन एक रासायनिक अभिक्रिया में भाग लेकर एक नए गुणधर्म वाले पदार्थ का निर्माण करते है जो जल (H2O) है|)
- दुसरे शब्दों में हम कह सकते है कि रासायनिक परिवर्तन को रासायनिक अभिक्रिया भी कहते है| हमारे आस-पास ऐसी बहुत सारी परिवर्तनें होती रहती है।
- रासायनिक परिवर्तन :- ऐसा परिवर्तन जो किसी पदार्थ के रासायनिक गुणों में परिवर्तन करता है। कथा इस प्रकार के परिवर्तन में पदार्थ को वापस उसी अवस्था में प्राप्त नहीं किया जा सकता है। रासायनिक परिवर्तन कहलाता है।
- रासायनिक परिवर्तन के गुण :- रासायनिक परिवर्तन के निम्न गुण है-
- इस प्रकार के परिवर्तन में सामान्यतः पदार्थ के रासायनिक गुणों में परिवर्तन होता है।
- रासायनिक परिवर्तन के पश्चात पदार्थ को पहले वाले अवस्था में प्राप्त नहीं किया जा सकता है।
- यह एक स्थाई परिवर्तन है।
- रासायनिक परिवर्तन के पश्चात एक नया पदार्थ का निर्माण होता है।
- उदाहरण जैसे दूध से दही जमना, लोहे पर जंग लगना इत्यादि।
- वायु के संपर्क में आने से जंग का लगाना
- अंगूर के रस का किण्वन
- भोजन का पकना
- हमारे शारीर में भोजन का पचना
- हम जो श्वसन करते है
रासायनिक अभिक्रिया की पहचान
रासायनिक अभिक्रिया की पहचान करना ताकि यह पता लगाया जा सके कि अभिक्रिया सम्पन्न हुई है जब कोई अभिक्रिया संपन्न होती है तो उसे निम्न चिन्हों से पहचाना जाता है
जैसे :
- पदार्थ की अवस्था में परिवर्तन
- रंग में परिवर्तन
- गैस का निष्कासन
- ताप में परिवर्तन
रासायनिक समीकरण
जब एक मैग्नीशियम रिबन को वायु में जलाया जाता है तो यह मैग्नीशियम ऑक्साइड में परिवर्तित हो जाता है| यह एक रासायनिक अभिक्रिया के लिए कथन है, परन्तु इसे निम्न तरीके से लिखा जा सकता है|
मैग्नीशियम + ऑक्सीजन → मैग्नीशियम ऑक्साइड
(अभिकारक) (उत्पाद)
नोट :- इस प्रकार समीकरणों को लिखना शब्द समीकरण कहलाता है रासायनिक अभिक्रिया को लिखने का दूसरा तरीका है
Mg + O2 → MgO
रासायनिक समीकरण को लिखने का सांकेतिक तरीका है किसी रासायनिक अभिक्रिया के समीकरणों के दो भाग होते है|
- अभिकारक :- वे पदार्थ जो किसी अभिक्रिया में भाग लेते है अभिकारक कहलाते है जैसे – ऊपर के समीकरण में मैग्नीशियम एवं ऑक्सीजन अभिक्रिया में भाग लेते है इसलिए ये दोनों अभिकारक है|

- उत्पाद :- किसी अभिक्रिया के दौरान नए बनने वाले पदार्थों को उत्पाद कहते है जैसे – MgO उत्पाद है जो Mg और O2 के भाग लेने से नया पदार्थ बना है|

रासायनिक समीकरणों को लिखना
रासायनिक समीकरण एक रासायनिक अभिक्रिया को प्रदर्शित करता है इसलिए रासायनिक समीकरण में तीर के निशान के बायीं ओर अभिकारकों को लिखा जाता है और उनके बीच में (+) चिन्ह लगाया जाता है, इसीप्रकार तीर के दाई ओर उत्पादों को लिखा जाता है और उनके बीच (+) चिन्ह लगाया जाता है|
इसको समझिये :
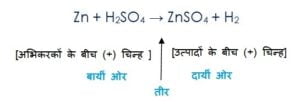
कंकाली रासायनिक समीकरण
Mg + O2 → MgO
इस समीकरण को निरीक्षण कीजिए एवं तीर के बायीं ओर और दायीं ओर के परमाणुओं की संख्या को गिनिए| प्रत्येक तत्व के दोनों ओर के अणुओं की संख्या समान नहीं है| ऑक्सीजन के परमाणुओं की संख्या थोड़ी असंतुलित है| बायीं ओर ऑक्सीजन के दो अणु है जबकि दायीं ओर सिर्फ 1 ही है|
इस प्रकार :- असंतुलित रासायनिक समीकरण को कंकाली समीकरण कहते है
कंकाली रासायनिक समीकरणों को संतुलित करना :- द्रव्यमान संरक्षण के नियम को संतुष्ट करने के लिए रासायनिक समीकरणों को संतुलित किया जाता है तीर के बाई ओर तथा दाई ओर ओर के तत्वों के परमाणुओं की संख्या समान किया जाता है जिससे दोनों ओर के तत्वों के परमाणु समान हो सके
रासायनिक अभिक्रियाओं के प्रकार
- रासायनिक अभिक्रियाओं में अणुओं के बीच बंध का बनने और टूटने से नए पदार्थ का निर्माण होता है| जैसे जल के अणुओं के टूटने से ऑक्सीजन तथा हाइड्रोजन उत्पन्न होते हैं जबकि कार्बन तथा ऑक्सीजन के बीच बंध बनने से कार्बन डाइऑक्साइड प्राप्त होता है|
रासायनिक अभिक्रियाएँ निम्न प्रकार की होती है|
- संयोजन अभिक्रिया
- वियोजन या अपघटन अभिक्रिया
- विस्थापन अभिक्रिया
- द्वि-विस्थापन
- उपचयन एवं अपचयन
1. संयोजन अभिक्रिया :-
- वह अभिक्रिया जिसमें दो या दो से अधिक अभिकारकों से एक एकल उत्पाद का निर्माण होता है तो ऐसी अभिक्रिया को संयोजन अभिक्रिया कहते है इस अभिक्रिया के लिए समान्य सूत्र : A + B → AB
CaO(s) + H2O(l) → Ca(OH)2(aq)
कैल्शियम ऑक्साइड जल कैल्शियम हाइड्रोऑक्साइड
(चुना) (बुझा हुआ चुना)

परिभाषा के अनुसार रासायनिक समीकरण से तुलना करने पर हम देखते है कि कैल्शियम ऑक्साइड और जल जो दो अभिकर्मक है एकल उत्पाद कैल्शियम हाइड्रोऑक्साइड बनाते हैं|
कैल्शियम हाइड्रोऑक्साइड Ca(OH)2 :- कैल्शियम हाइड्रोऑक्साइड का उपयोग दीवारों पर सफेदी करने के लिए किया जाता है यह एक अवक्षेपण अभिक्रिया है जब कैल्शियम हाइड्रोऑक्साइड से दीवारों पर पुताई की जाती है तो यह वायु में उपस्थित CO2 से अभिक्रिया करके कैल्शियम कार्बोनेट का एक पतला परत बनाता है और इसके साथ जल (H2O) का भी निर्माण होता है जो वाष्पीकृत हो जाता है इस प्रक्रिया का समीकरण इस प्रकार है|

Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)
कैल्शियम कैल्शियम
हाइड्रोऑक्साइड कार्बोनेट
अन्य संयोजन अभिक्रिया को देखते है
- कोयले का जलना :- C(s) + O2 (g) → CO2(g)
- जल का बनना :- 2H2(g) + O2(g) → H2O(l)
- सल्फर डाइऑक्साइड का बनना :- S(s) + O2(g) → SO2(g)
- जंग का लगना (फेरस ऑक्साइड का बनना) :- S(s) + O2(g) → SO2(g)
ऊष्मा के आधार पर रासायनिक अभिक्रिया के प्रकार
A. ऊष्माक्षेपी अभिक्रियाएँ :- वे अभिक्रियाएँ जिसमें अभिक्रिया के दौरान ऊष्मा निकलती है, ऊष्माक्षेपी अभिक्रिया कहलाती हैं उदाहरण:
- CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
- श्वसन भी एक ऊष्माक्षेपी अभिक्रिया का उदाहरण है जिसमें कोशिकाएँ श्वसन के दौरान ऊष्मा मुक्त करती है|
- शाक सब्जियों या सड़े – गले घास – फूस या पेड़ों के पत्तों का विघटन होकर कम्पोस्ट का बनना|

B. ऊष्माशोषी अभिक्रियाएँ :- वे अभिक्रियाएँ जिसमें ऊष्मा का शोषण होता है| ऊष्माशोषी अभिक्रिया कहलाती हैं| उदाहरण:

- Ba(OH)2 + 2NH4Cl → BaCl2 + 2NH4OH
2. वियोजन या अपघटन अभिक्रिया
- वे अभिक्रियाएँ जिनमें एकल अभिकारक वियोजित विघटित होकर दो या अधिक उत्पादों का निर्माण करता है विघटन अभिक्रियाएँ कहलाती है विघटन अभिक्रियाएँ तीन प्रकार के होती है
- ऊष्मीय वियोजन : इसमें वियोजन की क्रिया ऊष्मा के द्वारा होता है उदाहरण:
- विद्युत वियोजन :- इसमें ऊष्मा विद्युत के रूप में प्रदान की जाती है उदाहरण:
![]()
- प्रकाशीय वियोजन :- जब वियोजन की क्रिया के लिए ऊष्मा प्रकाश के द्वारा प्रदान की जाती हैं उदाहरण:

3. विस्थापन अभिक्रिया
- ऐसी अभिक्रियाएँ जिसमें अधिक अभिक्रियाशील पदार्थ कम अभिक्रियाशील पदार्थ को उसके यौगिक से अलग कर देता है विस्थापन अभिक्रिया कहलाती हैं

उदाहरण 1:
Fe(s) + CuSO4(aq) → FeSO4(aq) + Cu(s)
(कॉपर सल्फेट) (फेरम सल्फेट)
- यहाँ लोहा कॉपर से अधिक अभिक्रियाशील पदार्थ है जो अपने से कम अभिक्रियाशील कॉपर को उसके यौगिक कॉपर सल्फेट से अलग कर देता है इस अभिक्रिया में कॉपर सल्फेट का रंग नीला होता है परन्तु जैसे ही लोहे की कीलें विलयन में डालते है तो कॉपर के विस्थापन के कारण विलयन का रंग नीला से भूरा हो जाता है
उदाहरण 2:
Zn(s) + CuSO4(aq) → ZnSO४(aq) + Cu(s)
(कॉपर सल्फेट) (जिंक सल्फेट)
उदाहरण 3:
Pb(s) + CuCl2(aq) → PbCl2(aq) + Cu(s)
(कॉपर क्लोराइड) (लैड क्लोराइड)
- उदाहरण 2 तथा 3 में जिंक तथा लैड दोनों तत्वों ने कॉपर को अभिक्रिया में उसके यौगिक से विस्थापित कर देते है ऐसा इसलिए है क्योंकि कॉपर जिंक तथा लैड दोनों से कम अभिक्रियाशील है
4. द्वि–विस्थापन अभिक्रिया
- ऐसी अभिक्रिया जिसमें अभिकर्कों के बीच आयनों का आदान – प्रदान होता है द्वि – विस्थापन अभिक्रिया कहलाता है

- द्वि-विस्थापन अभिक्रिया के लिए सामान्य सूत्र (Ab + Cd → Ad + Cb)
उदाहरण:
- Na2SO4 + BaCl2 → BaSO4 + 2NaCl
- NaOH + H2SO4 → Na2SO4 + H2O
- NaCl + AgNO3 → AgCl + NaNO3
- BaCl2 + H2SO4 → BaSO4 + HCl
- BaCl2 + KSO4 → BaSO4 + KCl2
5. उपचयन एवं अपचयन अभिक्रिया
- उपचयन :- किसी पदार्थ में ऑक्सीजन की वृद्धि अथवा हाइड्रोजन का ह्रास होता है अथवा दोनों हो तो इसे उपचयन कहते हैं
उपचयन का उदाहरण:
ऑक्सीजन में वृद्धि के लिए-
(i) 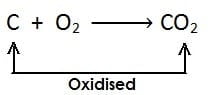
[कार्बन में ऑक्सीजन की वृद्धि होती है और यह कार्बन डाइऑक्साइड में उपचयित होता है]
(ii) 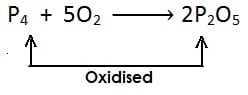
[फोस्फोरस में ऑक्सीजन की वृद्धि होती है एवं यह फोस्फोरस पेंटाऑक्साइड में उपचयित होता है]
(iii) 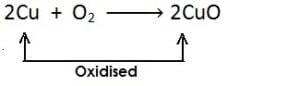
[इसमें कॉपर में ऑक्सीजन की वृद्धि होती है और यह कॉपर ऑक्साइड में उपचयित होता है] हाइड्रोजन का ह्रास:
उपचयन का उदाहरण:
(i) 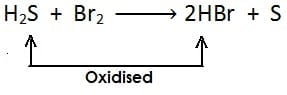
[सल्फर हाइड्राइड से हाइड्रोजन का ह्रास होता है और उपचयित होता है]
(ii) 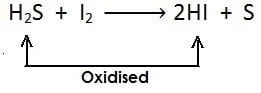
[यहाँ भी सल्फर हाइड्राइड से हाइड्रोजन का ह्रास होता है और उपचयित होता है]
(iii) 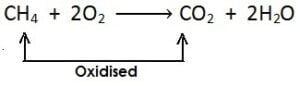
[यहाँ मीथेन से हाइड्रोजन का ह्रास होता है एवं यह उपचयित होता है]
अपचयन अभिक्रिया :- किसी पदार्थ में हाइड्रोजन की वृद्धि अथवा ऑक्सीजन का ह्रास अथवा दोनों हो तो इसे अपचयन कहते है| अपचयन का उदाहरण:

(i) 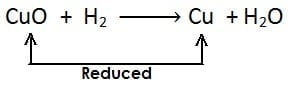
(ii)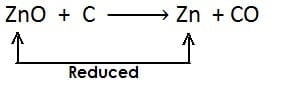
(iii) 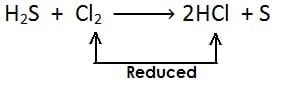
कभी – कभी ये दोनों अभिक्रियाएँ साथ – साथ होती है
रेडोक्स अभिक्रिया
- ऐसी अभिक्रिया जिसमें अभिक्रिया के दौरान एक अभिकारक उपचयित होता है जबकि दूसरा अपचयित होता है उसे रेडोक्स अभिक्रिया कहते हैं
- जब किसी अभिक्रिया के दौरान उपचयन की क्रिया एवं अपचयन की क्रिया एक साथ हो उसे रेडोक्स अभिक्रिया कहते हैं उदाहरण

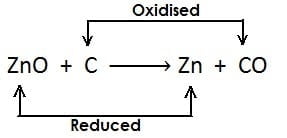
- यहाँ एक ही अभिक्रियाँ में उपचयन एवं अपचयन दोनों की क्रिया हो रही है इसलिए यह रेडोक्स अभिक्रिया है|
ऑक्सीकारक :- वह पदार्थ जो उपचयन के लिए ऑक्सीजन देता है या अपचयन के लिए हाइड्रोजन को हटाता है, ऑक्सीकारक कहलाता है|
अवकारक :- वह पदार्थ जो ऑक्सीजन के हटने के लिए उत्तरदायी होता है अथवा अपचयन के लिए हाइड्रोजन देता है, अवकारक कहलाता है उदाहरण:
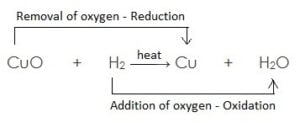
- यहाँ उपरोक्त उदाहरण में CuO कॉपर ऑक्साइड का कॉपर में अपचयन (अवकरण) होता है अत: CuO (कॉपर ऑक्साइड) अपचयित पदार्थ है| चूँकि CuO (कॉपर ऑक्साइड) उपचयन के लिए ऑक्सीजन प्रदान करता है, जिससे हाइड्रोजन ऑक्सीकृत होता है अत: कॉपर ऑक्साइड ऑक्सीकारक है
- H2 हाइड्रोजन जल H2O में आक्सीकृत होता है, अत: एवं यह ऑक्सीजन के CuO (कॉपर ऑक्साइड) से हटने के लिए उत्तरदायी है| H2 (हाइड्रोजन) एक अवकारक है|
सरांश :
- उपचयित पदार्थ : H2 // जिसमें ऑक्सीजन की वृद्धि होती है
- अपचयित पदार्थ : CuO // जिससे ऑक्सीजन का ह्रास होता है|
- ऑक्सीकारक : CuO // जो उपचयन के लिए ऑक्सीजन प्रदान करता है|
- अवकारक : H2 // जो ऑक्सीजन के ह्रास के लिए उत्तरदायी है|
उपचयन का प्रभाव
हमारे दैनिक जीवन में ऐसी बहुत सी अभिक्रियाएँ हमारे आस-पास होती रहती है जिसमें से धातुओं का संक्षारण एवं खाद्य पदार्थो का विकृतगंधित हो जाना सामान्य उदाहरण है जो उपचयन अभिक्रिया के प्रभाव से होता है

1. संक्षारण :- वह प्रक्रिया जिसमें हवा, जल एवं नमी से अभिक्रिया कर किसी धातु की सतह संक्षारित (गलना) हो जाती है तो ऐसी प्रक्रिया को संक्षारण कहते है
नोट- संक्षारण एवं जंग लगना दोनों अलग चीज है, जंग लगाने से लोहे जैसी धातु की सतह संक्षारित हो जाती है
संक्षारण से बचाव :- संक्षारण से बचाव की निम्न विधियाँ हैं|
- जस्तीकरण
- धातु की सतह को पेंट करके
- धातु की सतह पर तेल लगाकर या ग्रीस लगाकर
2. विकृतगंधिता :- भोजन में उपस्थित वसा एवं तेल का वायुजनित उपचयन जिससे उसका स्वाद एवं गंध बदल कर बदबूदार हो जाता है भोजन का इस प्रकार ख़राब होना विकृतगंधिता कहलाता है|
विकृतगंधिता एक घटना है जब बहुत समय रखने के बाद वसा /तेलीय खाद्य पदार्थ उपचयित हो जाता है जिससे उसका स्वाद बदल जाता है
- वसा अथवा तेल में तैयार किया गया खाद्य पदार्थ जैसे सब्जी, चिप्स, आदि को विकृतगंधित होने से ख़राब कर देता है|
- उपचयित खाद्य पदार्थ का स्वाद बदल जाता है|
- विकृत गंधित भोजन खाने योग्य नहीं होता है|
वसा एवं तेलीय खाद्य पदार्थ का विकृतगंधिता से बचाव
वसा एवं तेलीय खाद्य पदार्थ को विकृतगंधित होने से बचाया जा सकता है अथवा इसकी दर को कम किया जा सकता है इसको रोकने की निम्न विधियाँ हैं
- वसा एवं तेलीय खाद्य पदार्थों में एंटी-ऑक्सीडेंट डालने से इसे विकृतगंधित होने से बचाया जा सकता है
- खाद्य पदार्थों के पैकिंग के समय बर्तन से ऑक्सीजन गैस को हटा कर नाइट्रोजन गैस से भरा जाता है इससे विकृतगंधित होने से बचाया जा सकता है
- उपचयन की दर को कम करने के लिए वायु – मुक्त बर्तन में खाद्य पदार्थों को रखने से विकृतगंधित होने की दर को कम किया जा सकता है
- खाद्य पदार्थों को विकृतगंधिता से बचाने के लिए ऊष्मा एवं प्रकाश से दूर रखा जाता है
- खाद्य पदार्थों को विकृतगंधिता से बचाने के लिए एवं उसकी दर को कम करने के लिए रेफ्रीजेरेटर ने रखा जाता है
रासायनिक समीकरण को संतुलित करना
रासायनिक समीकरणों के संतुलित करने की विधि हम यहाँ निरिक्षण विधि या हिट्स एंड ट्रायल का उपयोग करेंगे

उदाहरण के लिए समीकरण Fe + H2O → Fe3O4 + H2को लेते है|
Steps:
- यह कल्पना करते हुए कि प्रत्येक सूत्र बॉक्स में है उन्हें निम्न प्रकार से बॉक्स में लिखिए| यह इसलिए कि बॉक्स के अन्दर कोई भी बदलाव नहीं होना चाहिए यह आपको ध्यान देना है|
![]()
- असंतुलित समीकरण में उपस्थित विभिन्न प्रकार के तत्वों के परमाणुओं का सूचि बनाइए एवं गिनती कीजिए| इस प्रकार से
पहले ये देखिए कि किस तत्व के परमाणुओं की संख्या सबसे अधिक है| यह अभिकारक या उत्पाद की ओर से हो सकता है| इसी कसौटी के उपयोग से हम पाया कि यौगिक Fe3O4 में O तत्व के सबसे अधिक 4 परमाणु हैं
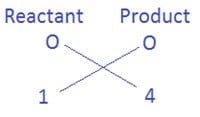
ऑक्सीजन के परमाणुओं की संख्या को बराबर करने के लिए, H2O के साथ गुणांक 4 लगाते है जिसे इस प्रकार 4H2O लिखेंगे| तब हमें यह समीकरण प्राप्त होता है|
Fe + 4H2O → Fe3O4 + H2
- अगला अधिकतम परमाणुओं वाला तत्व Fe है जिसे ठीक उसी नियम से संतुलित करना है|
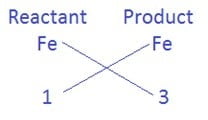
अभिकारक की ओर Fe के साथ गुणांक 3 लगाने पर 3Fe प्राप्त होता है, तब समीकरण होगा|
3Fe + 4H2O → Fe3O4 + H2
- अंत में हम दोनों पक्षों के हाइड्रोजन परमाणुओं को संतुलित करना है| अब हमें प्राप्त नए समीकरण में देखते है कि अभिकारक में हाइड्रोजन 4H2O के रूप में है एवं उत्पाद में H2 के रूप में है अभिकारक की ओर 4 × 2 = 8 परमाणु है जबकि उत्पाद की ओर सिर्फ 2 परमाणु है तब,
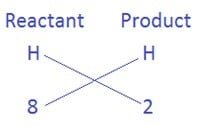
यहाँ अब पहले की तरह बायीं ओर दो और दाई ओर 8 नहीं लगायेंगे बल्कि अब 8 और 2 से गुणांक प्राप्त करेंगे जैसे (8 ÷ 2) = 4 तो गुणांक 4 होगा जो दाई ओर हाइड्रोजन के साथ लगाने से परिणाम 4 × 2 = 8 प्राप्त होगा| तब समीकरण होगा
3Fe + 4H2O → Fe3O4 + 4H2
अब हम यह देखते है कि यह समीकरण पूरी तरह संतुलित है|
उदाहरण – II
अब हम एक नए समीकरण को निरीक्षण विधि (हिट्स एंड ट्रायल) से हल करने की कोशिश करते हैं|
HNO3 + Ca(OH)2 → Ca(NO3)2 + H2O
(i) ऊपर दिए समीकरण को देखने से ज्ञात होता है कि के यौगिक के सबसे अधिक दो परमाणु/ अणु है| संतुलित करने के लिए हमारे पास LHS में 1 तथा RHS में 2 अणु हैं इसलिए
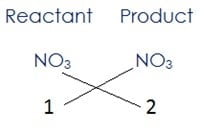
यहाँ नाइट्रोजन तथा ऑक्सीजन संतुलित हो जायेंगे जब 2NO3 अभिकारक की ओर और NO3 उत्पाद की ओर लिखते हैं, तब समीकरण प्राप्त होगा
2HNO3 + Ca(OH)2 → Ca(NO3)2 + H2O
(ii) यहाँ कैल्सियम स्वत: संतुलित हो चूका है अब हमें केवल हाइड्रोजन अणु को संतुलित करना है अभिकारक की ओर कुल 4 हाइड्रोजन परमाणु है और उत्पाद की ओर 2 हैं
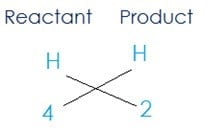
उत्पाद को 2 गुणांक के रूप में चाहिए क्योंकि (4 ÷ 2) = 2, तब समीकरण प्राप्त होगा
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
(iii) इस समीकरण में अब करने के लिए कुछ नहीं है इसलिए इसमें उपस्थित विभिन्न तत्वों के परमाणुओं की गिनती करने तथा सूची बनाने पर हमें प्राप्त होगा|
तत्व अभिकारक उत्पाद
O 8 8
N 2 2
Ca 1 1
H 4 4
इस प्रकार हम देखते है कि समीकरण संतुलित हो चूका है |
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
We hope that class 10 Science Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण (Chemical Reactions and Equations) Notes in Hindi helped you. If you have any queries about class 10 Science Chapter 1 रासायनिक अभिक्रियाएँ एवं समीकरण (Chemical Reactions and Equations) Notes in Hindi or about any other Notes of class 10 Science in Hindi, so you can comment below. We will reach you as soon as possible…