पाठ – 2
अम्ल, क्षारक एवं लवण
In this post we have given the detailed notes of class 10 Science chapter 2 Acids, Bases and Salts in Hindi. These notes are useful for the students who are going to appear in class 10 board exams.
इस पोस्ट में कक्षा 10 के विज्ञान के पाठ 2 अम्ल, क्षारक एवं लवण के नोट्स दिये गए है। यह उन सभी विद्यार्थियों के लिए आवश्यक है जो इस वर्ष कक्षा 10 में है एवं विज्ञान विषय पढ़ रहे है।
| Board | CBSE Board, UP Board, JAC Board, Bihar Board, HBSE Board, UBSE Board, PSEB Board, RBSE Board, CGBSE Board, MPBSE Board |
| Textbook | NCERT |
| Class | Class 10 |
| Subject | Science |
| Chapter no. | Chapter 2 |
| Chapter Name | अम्ल, क्षारक एवं लवण (Acids, Bases and Salts) |
| Category | Class 10 Science Notes in Hindi |
| Medium | Hindi |
Chapter – 2 अम्ल, क्षारक एवं लवण
संसूचक
- वे पदार्थ जो अपने रंग में परिवर्तन कर दुसरे पदार्थों के साथ अम्लीय या क्षारकीय व्यवहार करते हैं उन्हें संसूचक कहा जाता है
संसूचक के प्रकार
वैसे तो संसूचक बहुत प्रकार के होते है परन्तु इनके समान्य प्रकार इस प्रकार है :
(i) प्राकृतिक संसूचक :- वे सूचक जो प्राकृतिक स्रोतों के प्राप्त होते है प्राकृतिक संसूचक कहलाते है | जैसे – लिटमस, हल्दी, चाइना रोज, लाल गोभी आदि|
लिटमस :- लिटमस विलयन बैंगनी रंग का रंजक होता है जो थैलाफाइटा समूह के लाईकेन के पौधे से निकला जाता है| लिटमस विलयन जब न तो अम्लीय होता है न ही क्षारकीय, तब इसका रंग बैगनी होता है लिटमस पत्र दो रंगों का होता है – नीला एवं लाल| अम्ल नीले लिटमस पत्र को लाल कर देता है जबकि क्षार लाल लिटमस पत्र को नीला कर देता है
हल्दी :- हल्दी भी एक अन्य प्रकार का प्राकृतिक सूचक है| यह पीला रंग का होता है, कई बार आपने देखा होगा जब किसी सफ़ेद कपड़ों पर सब्जी का दाग लग जाता है और जब इसे साबुन (क्षारीय प्रकृति) से धोते है तो यह उस दाग के धब्बे को भूरा – लाल कर देता है|
- अम्ल के साथ हल्दी के रंग में कोई परिवर्तन नहीं होता है|
- क्षारक के साथ इसका रंग भूरा – लाल हो जाता है|
(ii) संश्लेषित संसूचक :- ये वे सूचक है जो प्राकृतिक नहीं होते अपितु ये रसायनिक पदार्थों द्वारा बनाए गए होते है| जैसे – मेथिल ऑरेंज एवं फिनोल्फ्थेलीन आदि| इनका उपयोग अम्ल एवं क्षारक की जाँच के लिए होता है|
(iii) गंधीय संसूचक :- कुछ ऐसे पदार्थ होते हैं जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है| ऐसे पदार्थों को गंधीय सूचक कहते हैं| जैसे – वैनिला, प्याज एवं लौंग आदि|
(iv) सार्वत्रिक सूचक :- सार्वत्रिक सूचक अनेक सूचकों का मिश्रण होता है| लिटमस, मेथिल ऑरेंज एवं फिनोल्फ्थेलीन आदि जैसे सूचकों के उपयोग से किसी विलयन के केवल अम्लीय या क्षारीय प्रकृति का ही पता लगाया जा सकता है परन्तु इस सार्वत्रिक सूचक के प्रयोग से अम्ल या क्षारक की प्रकृति के साथ – साथ उनकी प्रबलता की माप का माप भी बताता है|
अम्ल एवं क्षारक का रासायनिक गुणधर्म
अम्ल की धातु से अभिक्रिया :- अम्ल धातु से अभिक्रिया कर संगत धातु की लवण और हाइड्रोजन गैस प्रदान करता है
अम्ल + धातु → लवण + हाइड्रोजन गैस
जिंक के साथ हाइड्रोक्लोरिक अम्ल की अभिक्रिया से जिंक क्लोराइड और हाइड्रोजन गैस बनता है|
![]()
(हाइड्रोक्लोरिक अम्ल) (जिंक) (जिंक क्लोराइड) (हाइड्रोजन गैस’)
सोडियम के साथ हाइड्रोक्लोरिक अम्ल की अभिक्रिया से सोडियम क्लोराइड और हाइड्रोजन गैस बनता है|
![]()
(हाइड्रोक्लोरिक अम्ल) (सोडियम) (सोडियम क्लोराइड) (हाइड्रोजन गैस)\
धातु जिंक की सल्फ्यूरिक अम्ल के साथ अभिक्रिया से जिंक सल्फेट और हाइड्रोजन गैस का निर्माण होता है|
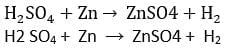
(सल्फ्यूरिक अम्ल) (जिंक) (जिंक सल्फेट) (हाइड्रोजन गैस)
हाइड्रोजन गैस की जाँच
- जब हम किसी धातु का किसी अम्ल से अभिक्रिया कराते है तो यह संगत लवण और हाइड्रोजन गैस उत्पन्न करता है| अभिक्रिया के इस अवधि के दौरान, जब हम एक जलती हुई मोमबत्ती इस गैस के पास ले जाते है तो यह पॉप ध्वनि उत्पन्न होती है| पॉप ध्वनि यह बताती है कि उत्पन्न गैस हाइड्रोजन है|

धातु कार्बोनेट /धातु हाइड्रोजनकार्बोनेट के साथ अम्ल की अभिक्रिया
चूनापत्थर, चाक और संगमरमर कैल्शियम कार्बोनेट के विभिन्न रूप है|सभी धातु कार्बोनेट और हाइड्रोजनकार्बोनेट अम्ल के साथ अभिक्रिया कर संगत लवण, कार्बन डाइऑक्साइड और जल प्रदान करता है| इस अभिक्रिया का समान्य रूप इस प्रकार है
धातु कार्बोनेट + अम्ल → लवण + कार्बन डाइऑक्साइड + जल
उदाहरण :
कैल्शियम क्लोराइड, हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया कर कैल्शियम क्लोराइड, कार्बन डाइऑक्साइड और जल प्रदान करता है|
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
(कैल्शियम कार्बोनेट) (हाइड्रोक्लोरिक अम्ल) (कैल्शियम क्लोराइड) (कार्बन डाइऑक्साइड) (जल) नाइट्रिक अम्ल, सोडियम कार्बोनेट के साथ अभिक्रिया कर सोडियम नाइट्रेट, कार्बन डाइऑक्साइड और जल बनाता है|
2NHO3 + Na2CO3 → NaNO3 + CO2 + 2H2O
(नाइट्रिक अम्ल) (सोडियम कार्बोनेट) (सोडियम नाइट्रेट) (कार्बन डाइऑक्साइड) (जल)
इसी प्रकार ये निम्न अभिक्रिया भी संपन्न होगी:
सोडियम कार्बोनेट + हाइड्रोक्लोरिक अम्ल → सोडियम क्लोराइड + कार्बन डाइऑक्साइड + जल
कैल्शियम कार्बोनेट + सल्फ्यूरिक अम्ल → कैल्शियम सल्फेट + कार्बन डाइऑक्साइड + जल
- धातु हाइड्रोजन कार्बोनेट और अम्ल की अभिक्रिया :- समान्य सूत्र
धातु हाइड्रोजन कार्बोनेट (बाईकार्बोनेट) + अम्ल → लवण + कार्बनडाइऑक्साइड + जल

उदाहरण:
सोडियम बाईकार्बोनेट, हाइड्रोक्लोरिक अम्ल से अभिक्रिया कर सोडियम क्लोराइड, कार्बन डाइऑक्साइड, और जल बनाता है|
NaHCO3 + 2HCl → NaCl + CO2 + H2O
(सोडियम बाईकार्बोनेट) (हाइड्रोक्लोरिक अम्ल) (सोडियम क्लोराइड) (कार्बन डाइऑक्साइड) (जल)
- धातु एवं क्षारक की अभिक्रिया
क्षारक धातुओं से अभिक्रिया कर संगत धातु का लवण और हाइड्रोजन गैस बनाते हैं| सोडियम हाइड्रोऑक्साइड जिंक के साथ अभिक्रिया कर सोडियम ज़िन्केट और हाइड्रोजन गैस देता है|
2NaOH(aq) + Zn(s) → Na2 ZnO2(aq) + H2(g)
(सोडियम हाइड्रोऑक्साइड) (जिंक) (सोडियम ज़िन्केट) (हाइड्रोजन गैस)
सोडियम हाइड्रोऑक्साइड एल्युमुनियम के साथ अभिक्रिया कर सोडियम एलुमिनेट और हाइड्रोजन गैस देता है|
2NaOH(aq) + 2Al(s) + 2H2O → 2NaAlO2(aq) + 2H2(g)
(सोडियम हाइड्रोऑक्साइड) (एल्युमीनियम) (जल) (सोडियम एलुमिनेट) (हाइड्रोजन गैस)
उदासीनीकरण अभिक्रिया
अम्ल और क्षारक की आपसी अभिक्रिया से लवण और जल का निर्माण होता है इस प्रकार की अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं|
उदासनिकरण अभिक्रिया को समान्य सूत्र में इस प्रकार से लिखा जाता है:
क्षारक + अम्ल → लवण + जल
अम्ल और क्षारक की अभिक्रिया

सोडियम हाइड्रोऑक्साइड, हाइड्रोक्लोरिक अम्ल से अभिक्रिया कर साधारण नमक और जल बनाता है|
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O
(सोडियम हाइड्रोऑक्साइड) (हाइड्रोक्लोरिक अम्ल) (सोडियम क्लोराइड) (जल)
सोडियम हाइड्रोऑक्साइड, नाइट्रिक अम्ल से अभिक्रिया कर सोडियम नाइट्रेट और जल बनाता है|
NaOH(aq) + HNO3 (aq) → NaNO3 (aq) + H2O
(सोडियम हाइड्रोऑक्साइड) (नाइट्रिक अम्ल) (सोडियम नाइट्रेट) (जल)
सोडियम हाइड्रोऑक्साइड, सल्फ्यूरिक अम्ल से अभिक्रिया कर सोडियम सल्फेट और जल बनाता है|
NaOH(aq) + H2SO4 → NaSO4(aq) + H2O
(सोडियम हाइड्रोऑक्साइड) (सल्फ्यूरिक अम्ल) (सोडियम सल्फेट) (जल)
धातु-ऑक्साइड का अम्लों के साथ अभिक्रिया
सभी धातु-ऑक्साइड क्षारकीय प्रकृति की होती हैं इसलिए ये अम्ल के साथ अभिक्रिया कर लवण एवं जल बनाती है यह बिल्कुल उदासीनीकरण अभिक्रिया की तरह ही होती है|
आयरन (III) ऑक्साइड सल्फ्यूरिक अम्ल से अभिक्रिया कर आयरन सल्फेट और जल बनाता है|
Fe2O3 + 3H2SO4 → Fe2 (SO4)3 + 3H2O
(फेरस III ऑक्साइड) (सल्फ्यूरिक अम्ल) ( फेरस सल्फेट) (जल)
कॉपर ऑक्साइड हाइड्रोक्लोरिक अम्ल से अभिक्रिया कर कॉपर क्लोराइड एवं जल प्रदान करता है|
CuO + 2HCl → CuCl2 + H2O
(कॉपर ऑक्साइड) (हाइड्रोक्लोरिक अम्ल) (कॉपर क्लोराइड) (जल)
कैल्शियम ऑक्साइड, हाइड्रोक्लोरिक अम्ल से अभिक्रिया कर कैल्शियम क्लोराइड एवं जल प्रदान करता है|
CaO(aq) + 2HCl(aq) → CaCl2 (aq) + H2O
(कैल्शियम ऑक्साइड) (हाइड्रोक्लोरिक अम्ल) (कैल्शियम क्लोराइड) (जल)
क्षारक और अधातु ऑक्साइड का अभिक्रिया
अधातुओं की प्रकृति अम्लीय होती है जो क्षारक से अभिक्रिया कर लवण एवं जल बनाता है, यह अभिक्रिया उदासीनीकरण अभिक्रिया के समान ही होता हैं|
क्षारक + अधात्विक ऑक्साइड → लवण + जल
सोडियम हाइड्रोक्साइड, कार्बन डाइऑक्साइड से अभिक्रिया कर सोडियम कार्बोनेट और जल देता है|
2NaOH(aq) + CO2 (g) → Na2CO3(s) + H2O
(सोडियम हाइड्रोक्साइड) (कार्बन ऑक्साइड) (सोडियम कार्बोनेट) (जल )
लवण
- लवण अम्ल एवं क्षारक के उदासीनीकरण अभिक्रिया का आयनिक उत्पाद है|
(i) अम्लीय लवण :- अम्लीय लवण प्रबल अम्ल एवं दुर्बल क्षारक के आपसी अभिक्रिया के फलस्वरूप प्राप्त होता है|
अम्लीय लवण: NH4Cl
HCl + NH4OH → NH4Cl + H2O
(प्रबल अम्ल) (दुर्बल क्षारक) (अम्लीय लवण)
(ii) उदासीन लवण :- उदासीन लवण प्रबल अम्ल एवं दुर्बल क्षारक के आपसी अभिक्रिया से प्राप्त होता है|
उदासीन लवण: NaCl
HCl + NaOH → NaCl + H2O
(प्रबल अम्ल) (प्रबल क्षारक) (उदासीन लवण)
(iii) क्षारकीय लवण :- क्षारकीय लवण प्रबल क्षारक एवं दुर्बल अम्ल की आपसी अभिक्रिया से प्राप्त होता है|
क्षारकीय लवण: NaC2H3O2
HC2H3O2 + NaOH → NaC2H3O2 + H2O
(दुर्बल अम्ल) (प्रबल क्षारक) (क्षारकीय लवण)
तनुकरण
- जल में अम्ल या क्षारक मिलाने पर आयन की सांद्रता (H3O+/ OH–) में प्रति इकाई आयतन में कमी हो जाती है| इस प्रक्रिया तो तनुकरण कहते हैं| अम्ल और क्षारक को तनुकृत किया जाता है|
- pH स्केल :- किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने के लिए एक स्केल विकसित किया गया है जिसे pH स्केल कहते हैं| इस स्केल में 1 से 14 तक अंक अंकित रहते है जो किसी अम्ल या क्षारक की प्रबलता और दुर्बलता के साथ-साथ उनके मान की बताता है| यह एक प्रकार का सार्वत्रिक सूचक होता है|
- हाइड्रोनियम आयन की सांद्रता जीतनी अधिक होगी उसका pH उतना ही कम होगा|
- किसी भी उदासीन विलयन के pH का मान 7 होगा|
- यदि pH स्केल में किसी विलयन का मान 7 से कम है तो यह अम्लीय होगा| 7 से कम होने पर H+ आयन की सांद्रता बढती है| अर्थात अम्ल की शक्ति बढ़ रही है|
- यदि pH का मान 7 से अधिक है वह क्षार होगा| 7 से अधिक होने पर OH- की की सांद्रता बढती है अर्थात क्षारक की शक्ति बढ़ रही है|
- प्रबल अम्ल :- जिस विलयन में अधिक संख्या में H+ आयन उत्पन्न करने वाले अम्ल प्रबल अम्ल कहलाते हैं|
- दुर्बल अम्ल :- जबकि कम H+ आयन उत्पन्न करने वाले अम्ल दुर्बल अम्ल कहलायेंगे| जिस विलयन में OH- आयन अधिक संख्या में होते हैं उसे प्रबल क्षारक कहते हैं|
- दुर्बल क्षारक :- जिस विलयन में OH- संख्या में होते हैं उन्हें दुर्बल क्षारक कहते हैं|
- हमारा रक्त 7.35 – 7.45 pH परास के बीच कार्य करता है जो औसतन pH मान 7.4 होता है|
- यदि रक्त का pH मान 7.45 से अधिक हो जाता है ऐसी अवस्था का एल्केलोसिस कहते है और यदि रक्त का pH का मान 7.35 से कम हो जाता है, ऐसी अवस्था को एसिडोसिस कहते हैं|
दैनिक जीवन में pH का महत्व
(i) रक्त और हमारा शरीर :- हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास (परिसर) range में ही जीवित रह सकते हैं। वर्षा के जल की pH मान जब 5.6 से कम हो जाती है तो वह अम्लीय वर्षा कहलाती है।
अम्लीय वर्षा की हानियाँ :- अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल के pH का मान कम हो जाता है। ऐसी नदी में जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
(ii) मिटटी की अम्लीयता :- कई बार किन्ही कारणों से अथवा अम्लीय वर्षा के कारण मिटटी का pH मान कम हो जाने से इस भूमि से अच्छी उपज नहीं मिलती है, चूँकि अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है| मिटटी में अम्लीय गुण बढ़ जाने से पौधों को नुकसान पहुँचता है, जिससे फसल अच्छी नहीं होती है|
मिटटी के pH परास को ठीक करने से उपाय :- मिटटी के अम्लीयता ख़त्म करने के लिए मिटटी में चाकपाउडर या चूना मिलाया जाता है ताकि इसकी अम्लीयता ख़त्म करके मिटटी की प्रकृति क्षारीय बन जाय|
(iii) अम्लीय माध्यम में भोजन का पचना :- pH का महत्व हमारे आमाशय से उत्पन्न हाइड्रोक्लोरिक अम्ल (HCl) से भी है| यह भी एक विशिष्ट pH पर उदर (पेट) को बिना हानि पहुँचाये भोजन के पाचन में सहायता करता है| समान्यत: हमारा उदर का pH परास लगभग 1.5 – 3.5 के बीच कार्य करता है| इनमें भी ये निम्न दो स्थितियाँ होती हैं|
- अल्प अम्लता :- कुछ व्यक्तियों में HCl का स्राव बहुत कम होता है जिससे उनके भोजन नहीं पचता अथवा कम पचता है| ऐसी अवस्था को अल्प – अम्लता (अपच) कहते है| ऐसे व्यक्ति को अपने भोजन के साथ अम्लीय पदार्थ जैसे निम्बू या सिरका लेना पड़ता है, अथवा पाचक-रस उत्पन्न करने वाली औषधीयाँ लेना पड़ता है|
- अति-अम्लता :- उदर में अत्यधिक अम्ल उत्पन्न होने की स्थिति में व्यक्ति उदर में दर्द एवं जलन का अनुभव करता है| इस दर्द या जलन से मुक्त होने के लिए ऐन्टासिड लेना पड़ता है|
(प्रति-अम्ल औषधि) :- ऐन्टासिड अम्ल के प्रभाव को कम करने वाले दुर्बल क्षारक होते है | जैसे – मिल्क ऑफ़ मैग्नेशिया (मैग्नेशियम हाइड्रोऑक्साइड), एल्युमीनियम हाइड्रोऑक्साइड तथा सोडियम हाइड्रोऑक्साइड जैसे दुर्बल क्षारक ऐन्टासिड के संघटक में शामिल होते है| ये अम्लीय प्रभाव को उदासीन कर देते हैं|
दन्त-क्षय :- समान्यत: मुँह का pH 5.5 रहता है | यदि इसका मान 5.5 से कम हो जाए तो दन्त-क्षय प्रारंभ हो जाता है| दाँतों का इनैमल (दत्तवल्क) कैल्शियम फोस्फेट का बना होताहै जो शरीर का सबसे कठोर पदार्थ है| यह दाँतों की बाहर से बचाव करता है| जब मुँह का pH 5.5 से कम हो जाता है तो यह धीरे-धीरे संक्षारित होने लगता है|
मुँह का pH कम होने का कारण :- जब हम भोजन या कोई मीठी चीज खाते हैं तो भोजन के पश्चात् मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थ रह जाते है जिस पर मुँह में उपस्थित बैक्टीरिया उसका निम्नीकरण करते है और उससे अम्ल उत्पन्न करते है| यह अम्ल इनेमल को नष्ट कर देता है जो दंत-क्षय का प्रमुख कारण बनता है|
दन्त-क्षय से बचाव :- भोजन के बाद मुँह साफ करने से इससे बचाव किया जा सकता है। मुँह की सफाई के लिए क्षारकीय दंत-मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है जिसके परिणामस्वरूप दंत क्षय को रोका जा सकता है।
क्लोर-क्षार प्रक्रिया
जब सोडियम क्लोराइड (साधारण नमक) के जलीय विलयन से विद्युत धारा प्रवाहित की जाती है तो यह वियोजित होकर सोडियम हाइड्रोऑक्साइड, क्लोरीन गैस और हाइड्रोजन गैस प्रदान करता है| इस प्रक्रिया को क्लोर-क्षार प्रकिया कहते हैं|
इस प्रक्रिया का रासायनिक समीकरण निम्न है :

2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2 (g) + H2(g)
सोडियम क्लोराइड का विद्युत अपघटन
जब सोडियम क्लोराइड के जलीय विलयन से विद्युत प्रवाहित की जाती है तो इसके एनोड से क्लोरीन गैस और कैथोड से हाइड्रोजन गैस उत्पन्न करता है| सोडियम हाइड्रोऑक्साइड विलयन इसके कैथोड के पास बनता है|
क्लोर-क्षार प्रक्रिया के उत्पाद
- सोडियम हाइड्रोऑक्साइड
- क्लोरीन गैस
- हाइड्रोजन गैस
सोडियम हाइड्रोऑक्साइड का उपयोग
- इसका उपयोग धातुओं से ग्रीज हटाने के लिए किया जाता है|
- साबुन और अपमार्जक बनाने में किया जाता है|
- इसका उपयोग कागज बनाने में भी किया जाता है|
- और इसका उपयोग कृत्रिम फाइबर बनाने में किया जाता है|
क्लोरीन गैस का उपयोग
- क्लोरीन गैस का उपयोग जल की स्वच्छता के लिए किया जाता है|
- स्विमिंग पूल में
- PVC, CFCs और कीटाणुनाशक बनाने ने किया जाता है|
- और इसका उपयोग रोगाणुनाशक बनाने में भी किया जाता है|

हाइड्रोजन गैस का उपयोग
- इसका उपयोग ईंधन के लिए किया जाता है|
- इसका उपयोग मार्गरीन बनाने के लिए किया जाता है|
- और इसका उपयोग खाद के लिए अमोनिया बनाने के लिए किया जाता है|

हाइड्रोक्लोरिक अम्ल का उत्पादन
क्लोरीन और हाइड्रोजन क्लोर-क्षार प्रक्रिया के महत्वपूर्ण उत्पादन है, जिनका उपयोग हाइड्रोक्लोरिक अम्ल के उत्पादन में किया जाता है| हाइड्रोक्लोरिक अम्ल एक महत्वपूर्ण रसायन है जिसका उपयोग निम्न पदार्थों के उत्पादन में किया जाता है|
- दवाइयों के निर्माण में,
- सौन्दर्य प्रसाधन के निर्माण में,
- अमोनियम क्लोराइड के निर्माण में और
- इस्पात के सफाई के लिए प्रयोग होता है|
विरंजक चूर्ण का उत्पादन
- क्लोर-क्षार प्रक्रिया से प्राप्त क्लोरीन और सुखे बुझे हुए चूने की क्रिया से विरंजक चूर्ण का निर्माण होता है|
- इस प्रक्रिया का रासायनिक समीकरण निम्नलिखित है
Ca(OH)2 + Cl2 → CaOCl2 + H2O
विरंजक चूर्ण का उपयोग
- वस्त्र उद्योग में सूती एवं लिनेन के विरंजन के कागज़ की पैफक्ट्री में लकड़ी के मज्जा एवं लाउंड्री में साफ कपड़ों के विरंजन के लिए
- कई रासायनिक उद्योगों में एक उपचायक के रूप में, एवं
- पीने वाले जल को जीवाणुओं से मुक्त करने के लिए रोगाणुनाशक के रूप में
बेकिंग सोडा का उत्पादन
- इस यौगिक का रासायनिक नाम सोडियम हाइड्रोजनकार्बोनेट (NaHCO3) है। कच्चे पदार्थों में सोडियम क्लोराइड का उपयोग कर इसका निर्माण किया जाता है।
- इसका रासायनिक समीकरण निम्न है
NaCl + H2O + CO2 + NH3 → NH4Cl + NaHCO3
(अमोनियम क्लोराइड) (सोडियम हाइड्रोजन कार्बोनेट)
इस प्रकिया के दो महत्वपूर्ण उत्पाद है (i) अमोनियम क्लोराइड और (ii) बेकिंग सोडा
बेकिंग सोडा का उपयोग
- सोडा का उपयोग आमतौर पर रसोईघर में स्वादिष्ट खस्ता पकौड़े बनाने के लिए किया जाता है।
- कभी-कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है।
- यह एक दुर्बल क्षारक भी है जिसका उपयोग कई बार अति-अम्लता की स्थिति में की जाती है | यह ऐन्टैसिड का संघटक भी है|
- इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है|
- इसका उपयोग बेकिंग पाउडर को बनाने में किया जाता है|
- खाना पकाते समय जब इसे गर्म किया जाता है तो निम्न अभिक्रिया होती है:
![]()
बेकिंग पाउडर का निर्माण
- बेकिंग सोडा एवं टार्टरिक अम्ल जैसा मंद खाध्य अम्ल के मिश्रण से बेकिंग पाउडर का निर्माण होता है|
- जब बेकिंग पाउडर को जल में मिलाकर गर्म किया जाता है तो यह कार्बन डाइऑक्साइड जल और अम्ल का सोडियम लवण प्रदान करता है जिसकी निम्न अभिक्रिया होती है :
- NaHCO3 + H+ → CO2 + H2O + अम्ल का सोडियम लवण इस अभिक्रिया से कार्बन डाइऑक्साइड उत्पन्न होता है जो ब्रेड या केक को फुलाने, स्पोंजी बनाने या मुलायम बनाता है |
We hope that class 10 Science Chapter 2 अम्ल, क्षारक एवं लवण (Acids, Bases and Salts) Notes in Hindi helped you. If you have any queries about class 10 Science Chapter 2 अम्ल, क्षारक एवं लवण (Acids, Bases and Salts) Notes in Hindi or about any other Notes of class 10 Science in Hindi, so you can comment below. We will reach you as soon as possible…