पाठ – 3
परमाणु एवं अणु
In this post we have given the detailed notes of class 9 Science chapter 3 Pure Atoms and Molecules Pure in Hindi. These notes are useful for the students who are going to appear in class 9 board exams.
इस पोस्ट में कक्षा 9 के विज्ञान के पाठ 3 परमाणु एवं अणु के नोट्स दिये गए है। यह उन सभी विद्यार्थियों के लिए आवश्यक है जो इस वर्ष कक्षा 9 में है एवं विज्ञान विषय पढ़ रहे है।
| Board | CBSE Board, UP Board, JAC Board, Bihar Board, HBSE Board, UBSE Board, PSEB Board, RBSE Board, CGBSE Board, MPBSE Board |
| Textbook | NCERT |
| Class | Class 9 |
| Subject | Science |
| Chapter no. | Chapter 3 |
| Chapter Name | परमाणु एवं अणु (Pure Atoms and Molecules Pure) |
| Category | Class 9 Science Notes in Hindi |
| Medium | Hindi |
पाठ 3 परमाणु एवं अणु
रासायनिक संयोजन का नियम
तत्व(Element): किसी पदार्थ का वह मुल पदार्थ जिसे सरलीकृत नहीं किया जा सके तत्व कहलाता है |
जैसे- हाइड्रोजन, कार्बन, ऑक्सीजन, आयरन, चाँदी और सोना आदि |
परमाणु (Atom): पदार्थ का वह सूक्ष्मतम कण जिसे और आगे विभाजित नहीं किया जा सके वह परमाणु कहलाता है |
अणु (Molecules): एक ही तत्व या भिन्न-भिन्न के दो या दो से अधिक परमाणुओं के समूह जो रासायनिक से एक दुसरे से बंधे होते है अणु कहलाते हैं |
उदाहरण: O2, H2, N2, H2O, CO2, MgCl2 इत्यादि |
यौगिक (Compound): अणु जो एक से अधिक तत्वों से मिलकर बना है यौगिक कहलाता है |
उदाहरण: H2O, CO2, NH3, BrCl2, CH4 इत्यादि |
किसी तत्व के सबसे छोटे कण परमाणु होते हैं | जैसे – हाइड्रोजन के परमाणु (H), ऑक्सीजन के परमाणु (O), कार्बन के परमाणु (C), मैग्नीशियम के परमाणु (Mg) इत्यादि |
परमाणु की अवधारणा
सभी द्रव्यों की रचनात्मक इकाई परमाणु होता है | दुसरे शब्दों में, जैसे एक मकान की संरचनात्मक इकाई एक ईंट होता है ठीक उसी प्रकार सभी द्रव्यों की संरचनात्मक इकाई परमाणु है जिससे वह पदार्थ बना है |
परमाणु त्रिज्या को नेनोमीटर (nm) में मापा जाता है |
1 nm = 10-9 m
1 m = 109 nm
अत: सभी पदार्थ इन तत्वों के छोटे -छोटे कणों परमाणु से मिलकर बने हैं |
पदार्थ का निर्माण:
तत्वों के परमाणु (Atoms of elements)
⇓
अणु या परमाणु (Molecules Or atoms)
⇓
यौगिक (Compounds)
⇓
पदार्थ (Matters)
रासायनिक संयोजन का नियम (Laws of Chemical Combination):
रासायनिक संयोजन का नियम अन्तोनी एल. लावोइजिए (Antonie L. Lavoisier) और जोशेफ़ एल. प्रोउस्ट (Joseph L. Proust) ने प्रतिपादित किये |
रासायनिक संयोजन के दो नियम है:
1. द्रव्यमान संरक्षण का नियम (Law of conservation of mass):द्रव्यमान संरक्षण के नियम के अनुसार किसी रासायनिक अभिक्रिया में द्रव्यमान का नहीं तो सृजन होता है और नहीं विनाश होता है |
नोट: इसका अर्थ यह हुआ कि किसी भी रासायनिक समीकरण के दो भाग होते है (i) अभिकारक और (ii) उत्पाद तो यदि हम उस अभिक्रिया में अभिकारक के रूप में मान लीजिये कि 2 ग्राम हाइड्रोजन और 16 ग्राम ऑक्सीजन का उपयोग करते है तो उत्पाद में कुल 18 ग्राम जल प्राप्त होगा | इसका मतलब यह हुआ कि अभिक्रिया के दौरान अभिकारक के पदार्थ नहीं तो घटेगा और नहीं वह उत्पाद के साथ बढेगा |
2. निश्चित अनुपात का नियम (Law of constant proportions):इस नियम के अनुसार “किसी भी यौगिक में तत्व सदैव एक निश्चित द्रव्यमान के अनुपात में विद्यमान होते हैं |”
नोट: इसका अर्थ यह हुआ कि कोई यौगिक चाहे वह किसी भी प्रान्त, देश, महादेश अथवा सृष्टि के किसी भी भाग का क्यों न हो यदि वह वही यौगिक है जिसके तत्व निश्चित अनुपात में हैं और हम जिसकी चर्चा कर रहे है तो वह भी उसी अनुपात में होगा | उदाहरण के लिए हमने पृथ्वी से जल का एक नमूना लिया और देखा की इसमे हाइड्रोजन और ऑक्सीजन 1: 8 के अनुपात में है | तो यदि चाँद पर मिले जल के नमूने में भी हाइड्रोजन और ऑक्सीजन ही होंगे और वे भी 1: 8 के अनुपात में ही होंगे |
डाल्टन का परमाणु सिद्धांत (Dalton’s Atomic Theory):
ब्रिटिश रसायनशास्त्री जॉन डाल्टन ने पदार्थ के प्रकृति के बारे में एक अधारभूत सिद्धांत प्रस्तुत किया। डाल्टन ने द्रव्यों की विभाज्यता का विचार प्रदान किया जिसे उस समय तक दार्शनिकता माना जाता था। ग्रीक दार्शनिकों के द्वारा द्रव्यों के सूक्ष्मतम अविभाज्य कण, जिसे परमाणु नाम दिया था, उसे डाल्टन ने भी परमाणु नाम दिया। डाल्टन का यह सिद्धांत रासायनिक संयोजन के नियमों पर आधरित था।
डाल्टन के परमाणु सिद्धांत के अनुसार, “सभी द्रव्य चाहे तत्व, यौगिक या मिश्रण हो, सूक्ष्म कणों से बने होते हैं जिन्हें परमाणु कहते हैं।“
डाल्टन के परमाणु सिद्धांत की अवधारणा (The postulates of dalton’s theory):
- (i) सभी द्रव्य परमाणुओं से निर्मित होते हैं।
- (ii) परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो सृजित होते हैं, न ही उनका विनाश होता है।
- (iii) दिए गए तत्व के सभी परमाणुओं का द्रव्यमान एवं रासायनिक गुणधर्म समान होते हैं।
- (iv) भिन्न-भिन्न तत्वों के परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म भिन्न-भिन्न होते हैं।
- (v) भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक
निर्मित करते हैं। - (vi) किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।
तत्वों के नाम और उनका प्रतिक चिन्ह (The name of elements and its symbol):
आजकल इंटरनेशनल यूनियन ऑफ़ प्योर एंड एप्लाइड केमिस्ट्री IUPAC तत्वों के नामों को स्वीकृति प्रदान करती है। अधिकतर तत्वों के प्रतीक उन तत्वों के अंगे्रजी नामों के एक या दो अक्षरों से बने होते हैं। किसी प्रतीक के पहले अक्षर को सदैव बड़े अक्षर (Capital Letter) में तथा दूसरे अक्षर को छोटे अक्षर (small letter) में लिखा जाता है।
उदाहरण: हाइड्रोजन: H
कार्बन: C
एल्युमीनियम: Al
मैग्नेशियम: Mg
कुछ तत्वों के प्रतीक उनके अंग्रेजी नामों के प्रथम अक्षर तथा बाद में आने वाले किसी एक अक्षर को संयुक्त करके बनाते हैं।
उदाहरण के लिए:
क्लोरीन, Cl,
जिंक, Zn इत्यादि.
प्रत्येक तत्व के नाम और उनके प्रतिक चिन्ह भिन्न होता है |
कुछ तत्वों के उदाहरण और उनके प्रतिक चिन्ह:
तत्व | प्रतिक चिन्ह | तत्व | प्रतिक चिन्ह |
एल्युमिनियम आर्गन बेरियम बोरोन कैल्शियम कार्बन क्लोरीन’ | Al Ar Ba B Br C Cl | कॉपर फ्लोरीन सोना हाइड्रोजन आयोडीन लोहा सीसा | Cu F Au H I Fe Pb |
परमाणु द्रव्यमान Atomic Mass:
डाल्टन के परमाणु सिद्धांत की उपलब्धियाँ (Achievvements of Dalton’s Atomic Theory):
(i) डाल्टन के परमाणु सिद्धांत में परमाणु द्रव्यमान सबसे विशिष्ट संकल्पना थी और उनके अनुसार प्रत्येक तत्व का एक अभिलाक्षणिक परमाणु द्रव्यमान होता है |
(ii) डाल्टन का सिद्धांत स्थिर अनुपात के नियम को इतनी भली-भाँति समझाने में समर्थ था कि वैज्ञानिक इससे प्रेरित होकर परमाणु द्रव्यमान को मापने की ओर अग्रसर हुए।
(iii) एक परमाणु के द्रव्यमान को ज्ञात करना अपेक्षाकृत कठिन कार्य था इसलिए रासायनिक संयोजन के नियमों के उपयोग एवं उत्पन्न यौगिको के द्वारा सापेक्ष परमाणु द्रव्यमानों को ज्ञात किया गया।
परमाणु द्रव्यमान इकाई:
कार्बन -12 समस्थानिक (isotope) के एक परमाणु द्रव्यमान के 1/12 वें भाग को परमाणु द्रव्यमान इकाई के मानक इकाई के रूप में लिया गया है | और इसी के आधार पर अन्य परमाणुओं के द्रव्यमान को प्राप्त किया गया है |
परिभाषा: किसी तत्व के सापेक्षिक परमाणु द्रव्यमान को उसके परमाणुओं के औसत द्रव्यमान का कार्बन-12 परमाणु के द्रव्यमान के 1/12वें भाग के अनुपात को परमाणु द्रव्यमान इकाई कहते है |
परमाणु द्रव्यमान इकाई को पहले amu से लिखा जाता था लेकिन वर्त्तमान में अब ‘u’ यूनिफाइड द्रव्यमान द्वारा प्रदर्शित किया जाता है |
उदाहरण:
ऑक्सीजन (O) का परमाणु द्रव्यमान = 16u
जिंक (Zn) का परमाणु द्रव्यमान = 65u
सोडियम (Na) का परमाणु द्रव्यमान = 23u
कार्बन (C) का परमाणु द्रव्यमान = 12u
परमाणु का अस्तित्व:
अधिकांश तत्वों के परमाणु स्वतंत्र रूप से अस्तित्व में नहीं रह पाते। परमाणु अणु एवं आयन बनाते हैं। ये अणु अथवा आयन अत्यधिक संख्या में पुंजित होकर द्रव्य अर्थात पदार्थ का निर्माण करते हैं |
अणु (Molecule):
अणु ऐसे दो या दो से अधिक परमाणुओं का समूह होता है जो आपस में रासायनिक बंध् द्वारा
जुड़े होते है अथवा वे परस्पर आकर्षण बल के द्वारा कसकर जुड़े होते हैं। यह किसी तत्व या यौगिक का सूक्ष्मतम कण होता है |
अणु के गुण (Properties of Melecules):
- (i) ये स्वतंत्र रूप से अस्तित्व में रह सकते हैं |
- (ii) किसी तत्व या यौगिक का अणु उस तत्व या यौगिक के सभी गुण धर्म को प्रदर्शित करते हैं |
- (iii) एक ही तत्व के परमाणु अथवा भिन्न-भिन्न तत्वों के’ परमाणु परस्पर संयोग करके अणु निर्मित करते हैं।
तत्वों के परमाणु (Atoms of Elements):
- (i) किसी तत्व के अणु एक ही प्रकार के परमाणुओं द्वारा संरचित होते हैं |
- (ii) आर्गन (Ar) हीलियम (He) इत्यादि जैसे अनेक उत्कृष्ट (गैसों) तत्वों के अणु उसी तत्व के केवल एक परमाणु द्वारा निर्मित होते हैं। अत: ये एक परमाणुक होते हैं क्योंकि उत्कृष्ट गैसें किसी भी तत्व से यहाँ तक की खुद से भी संयोजन नहीं करती है |
अणु की परमाणुकता (Atomicity of Atom):
किसी अणु संरचना में प्रयुक्त होने वाले परमाणुओं की संख्या को उस अणु की परमाणुकता कहते है | जैसे –
ऑक्सीजन के अणु (O2) की परमाणुकता 2 है |
फोस्फोरस के अणु (P4) की परमाणुकता 4 है |
सल्फर के अणु (S8) की परमाणुकता 8 है |
अत: किसी तत्व के अणु या यौगिक जितने परमाणुओं से मिलकर बने होते है वही संख्या उस तत्व या यौगिक की परमाणुकता होती है |
यह निम्नलिखित प्रकार के होते है:
(i) एक परमाणुक (Monoatomic): आर्गन (Ar) हीलियम (He) इत्यादि जैसे अनेक उत्कृष्ट (गैसों) तत्वों के अणु केवल एक परमाणु द्वारा निर्मित होते हैं। अत: इन्हें एक परमाणुक कहते है |
उदाहरण:
(a) हीलियम (He)
(b) आर्गन (Ar)
(c) निओन (Ne)
(d) क्रीप्टोन (Kr)
(e) जेक्नोंन (Xe)
(f) राडोन (Rn)
(ii) द्वि परमाणुक (Diatomic): कुछ तत्व जैसे ऑक्सीजन, हाइड्रोजन और क्लोरीन आदि अपने दो परमाणुओं से अणु बनाते हैं | ऐसे तत्व को द्वि-परमाणुक अणु कहते हैं |
उदाहरण:
(a) हाइड्रोजन (H2)
(b) ऑक्सीजन (O2)
(c) नाइट्रोजन (N2)
(d) फ्लोरीन (F2)
(e) क्लोरीन (Cl2)
(f) ब्रोमिन (Br2)
(iii) त्रि-परमाणुक (Triatomic): वह अणु जो तीन परमाणुओं से मिलकर बना होता है त्रि-परमाणुक अणु कहलाता है |
जैसे – ओजोन (O3)
(iv) चतुर्परमाणुक (Tetra-atomic): किसी तत्व के वें अणु जिसमें चार परमाणु होते हैं चतुर्परमाणुक अणु कहलाता है |
जैसे – फोस्फोरस (P4)
(v) बहु-परमाणुक (Poly-atomic): किसी तत्व के वें अणु जिसमें परमाणुओं की संख्या चार से अधिक हो बहुपरमाणुक अणु कहलाता है | जैसे –
(a) सल्फर (S8)
(b) फुलेरिन (C60)
(c) बोरोन (B12)
यौगिकों के अणु
भिन्न-भिन्न तत्वों के परमाणु एक निश्चित अनुपात में परस्पर जुड़कर यौगिकों के अणु का निर्माण करते हैं।
जैसे –
यौगिक | संयुक्त तत्व | द्रव्यमान का अनुपात |
जल (H2O) अमोनिया (NH4) कार्बन डाइऑक्साइड | हाइड्रोजन और ऑक्सीजन नाइट्रोजन और हाइड्रोजन कार्बन और ऑक्सीजन |
1: 8 14: 3 3: 8 |
आयन एवं बहुपरमाणुक आयन
किसी भी परमाणु में चाहे वो किसी भी तत्व का परमाणु क्यों न हो सभी में तीन अवपरमाणुक कण होते हैं |
(i) प्रोट्रान: यह धन आवेशित (+) कण होता है जो परमाणु के नाभिक में रहता है | यह तत्व के सभी रासायनिक गुण धर्म को प्रदर्शित करता है | परमाणु में प्रोट्रान के घटने या बढ़ने से उसके रासायनिक गुणधर्म भी बदल जाते हैं |
(ii) इलेक्ट्रान: परमाणु: यह ऋण आवेशित (-) कण है जो नाभिक के चारों ओर भिन्न-भिन्न और निश्चित कक्षाओं में चक्कर काटते हैं |
(iii) न्यूट्रॉन: न्यूट्रॉन परमाणु के नाभिक में उपस्थित बिना आवेश वाला कण है जिस पर कोई आवेश नहीं होता है |
उदासीन परमाणु: समान्यत: कोई भी परमाणु उदासीन होता है क्योंकि परमाणु में धन प्रोट्रानो की संख्या ऋण इलेक्ट्रानों की संख्या के बराबर होता है यही कारण है कि किसी भी परमाणु पर नेट आवेश शून्य होता है और परमाणु उदासीन होता है |
जैसे ऑक्सीजन (O) के परमाणु में 8 धन प्रोट्रान होते है उतनी ही ऋण इलेक्ट्रान होते है |
इलेक्ट्रोनिक विन्यास (Electronic Configuration): किसी परमाणु के विभिन्न कोशों में इलेक्ट्रोनों के वितरण को इलेक्ट्रोनिक विन्यास कहते हैं |
हाइड्रोजन का इलेक्ट्रॉनिक संरचना:

हाइड्रोजन में 1 इलेक्ट्रान होता है अत: इसके बाह्यतम कक्षा K में केवल एक ही इलेक्ट्रान रहता है |
कार्बन के परमाणु का इलेक्ट्रॉनिक संरचना:
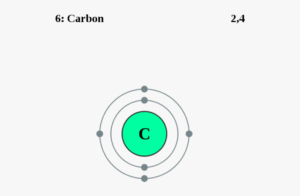
कार्बन के पास कुल 6 इलेक्ट्रॉन्स होते है तो इसके सबसे भीतरी कक्षा K में 2 इलेक्ट्रान रहता है और बहरी कक्षा L में शेष बचे 4 इलेक्ट्रॉन्स रहता है |
ये कोश होते हैं:
K, L, M, N आदि
कोश K में अधिकतम 2 इलेक्ट्रॉन्स रह सकते हैं |
कोश L में अधिकतम 8 इलेक्ट्रॉन्स रह सकते हैं |
कोश M में अधिकतम 18 इलेक्ट्रॉन्स रह सकते हैं और
कोश N में अधिकतम 32 इलेक्ट्रॉन्स रह सकते हैं |
कोशों में अधिकतम इलेक्ट्रॉन्स को रखने के लिए एक सूत्र है: 2n2
जिसके आधार अधिकतम इलेक्ट्रॉन्स की संख्या ज्ञात की जाती है:
जैसे पहले कोश K के लिए: 2(1)2 = 2 x 1 = 2
दुसरे कोश L के लिए: 2(2)2 = 2 x 4 = 8
तीसरे कोश M के लिए: 2(3)2 = 2 x 9 = 18
चौथे कोश N के लिए: 2(4)2 = 2 x 16 = 32
संयोकजता (valency): किसी परमाणु के बाह्यतम कक्षा में उपस्थिति संयोजी इलेक्ट्रॉन्स की संख्या को उस तत्व की संयोजकता कहते हैं |
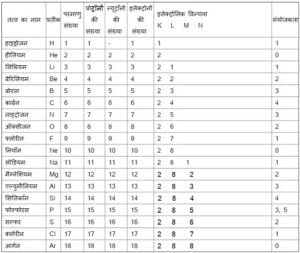
जैसे: कुछ तत्वों का इलेक्ट्रॉनिक विन्यास और उनकी संयोजकता:
जैसे किसी तत्व के बाह्यतम कक्षा में 1 इलेक्ट्रॉन् है तो उसकी संयोजकता 1 ही होगी | यदि उसके बाह्यतम कक्षा में 2 , 3 या 4 है तो उसकी संयोजकता भी क्रमश: 2, 3 या 4 होगी | यदि बाह्यतम कोश में 5, 6 या 7 इलेक्ट्रॉन्स है तो संयोजकता निम्नानुसार ज्ञात किया जाता है |
जब बाह्यतम कोश में 5 हो तो संयोजकता = 8 – 5 = 3
जब बाह्यतम कोश में 6 हो तो संयोजकता = 8 – 6 = 2
जब बाह्यतम कोश में 7 हो तो संयोजकता = 8 – 7 = 1
जब बाह्यतम कोश में 8 हो तो संयोजकता = 8 – 8 = 0
अब यह तालिका देखिए:
आयन:
किसी परमाणु के आवेशित कणों को आयन कहते है |
- धातु एवं अधातु युक्त आवेशित कणों से बने होते है |
- इन आयनों पर ऋण अथवा धन आवेश होता है |
- ऋण आवेशित कण को ऋणायन (anion) तथा धन आवेशित कण को धनायन (cation) कहते है |
- जो तत्व धनायन (cation) बनाते है उनपर (+) का चिन्ह लगा कर दर्शाया जाता है और जो ऋणायन (anion) बनाते है उन पर (-) का चिन्ह लगाया जाता है |
- आयन एक आवेशित परमाणु अथवा परमाणुओं का एक ऐसा समूह होता है
जिस पर नेट आवेश विद्यमान होता है।
बहुपरमाणुक आयन:
परमाणुओं के समूह जिन पर नेट आवेश विद्यमान हो उसे बहुपरमाणुक आयन कहते हैं।
उदाहरण: N3- + H44+ = NH4+
यहाँ नाइट्रोजन पर 3 ऋण आवेश है और हाइड्रोजन पर 4 धन आवेश है तो कुल नेट आवेश अर्थात शुद्ध आवेश 1 धन (+) प्राप्त होगा | अत: यह अणु एक धन आवेश (+) वाला बहुपरमाणविक आयन बनाएगा |
अमोनियम (Ammonium) NH4+
कार्बोनेट (Carbonate) CO3–
हाइड्रोऑक्साइड (Hydroxide) OH–
नाइट्रेट (Nitrate) NO3–
नाइट्राइट (Nitrite) NO2–
फॉस्फेट (Phosphate) PO43-
सल्फेट (Sulfate) SO42-
सल्फाईट (Sulfite) SO32-
परमाणु तथा आयन में अंतर:
परमाणु:
- यह विद्युत उदासीन कण होते हैं |
- इसमें प्रोट्रॉन तथा इलेक्ट्रान बराबर संख्या में होते हैं |
- अक्रिय गैस को छोड़कर सभी परमाणुओं का इलेक्ट्रोनिक रचनाएँ अस्थायी होते हैं |
- ये स्वतंत्र रूप से अस्तित्व में नहीं रह सकते हैं |
- ये आयनिक अभिक्रिया में भाग नहीं लेते हैं |
- ये अस्तित्व में बने रहने के लिए इलेक्ट्रॉन्स की साझेदारी करते हैं |
आयन:
- यह विद्युत आवेशित कण होते हैं |
- इसमें प्रोट्रॉन तथा इलेक्ट्रान बराबर संख्या में नहीं होते हैं |
- आयनों का इलेक्ट्रोनिक रचनाएँ स्थायी होते हैं |
- ये स्वतंत्र रूप से अस्तित्व में रह सकते हैं |
- ये आयनिक अभिक्रिया में भाग लेते हैं |
- ये अस्तित्व में बने रहने के लिए इलेक्ट्रान को ग्रहण करते है या त्याग करते है |
सरल यौगिकों का निर्माण
रासायनिक सूत्र लिखते समय निम्न नियमों का पालन करे:
- (i) आयन की संयोजकता अथवा आवेश संतुलित होना चाहिए।
- (ii) जब एक यौगिक किसी धातु एवं अधातु के संयोग से निर्मित होता है तो धातु के नाम अथवा उसके प्रतीक को रासायनिक सूत्रा में पहले लिखते हैं। उदाहरणार्थः कैल्सियम ऑक्साइड
(CaO) सोडियम क्लोराइड (NaCl) आयरन सल्फाइड (FeS) ऑक्साइड (CuO) इत्यादि | - (iii) आॅक्सीजन, क्लोरीन, सल्फर अधातुयें हैं तथा उन्हें दायीं तरफ लिखते हैं, जबकि कैल्सियम, सोडियम, आयरन एवं काॅपर धातुएँ हैं तथा उन्हें बायीं तरपफ लिखते हैं।
- (iv) बहुपरमाणुक आयनों द्वारा निर्मित यौगिकों में आयन को पहले कोष्ठक में रखते हैं। तत्पश्चात् अनुपातों को दर्शाने वाली संख्या को लिखते हैं।
द्विअंगी यौगिक: दो भिन्न-भिन्न तत्वों से निर्मित सरलतम यौगिकों को द्विअंगी यौगिक कहते हैं |
सरल यौगिकों के सूत्र लिखना:
आण्विक यौगिकों के रासायनिक सूत्र लिखते समय हम पहले संघटक तत्वों के प्रतीक लिखकर
उनकी संयोजकताएँ लिखते हैं तत्पश्चात् संयोजित परमाणुओं की संयोजकताओं को क्रॉस करके (cross over) अणु सूत्र लिखते हैं।
यहाँ अणु में भाग लेने वाले दोनों तत्व अधातु हैं |
उदाहरण 1:
हाइड्रोजन क्लोराइड का सूत्र:
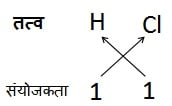
अत: सूत्र: HCl
उदाहरण 2:
हाइड्रोजन सल्फाईड़ का सूत्र:

उदाहरण 3:
कार्बन टेट्राक्लोराइड का सूत्र:
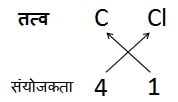
अत: सूत्र: CCl4
आयनिक यौगिकों का सूत्र (Formula of Ionic Compound): इसमें पहला तत्व धातु होता है जो धनायन (cation) बनाता है और दूसरा तत्व अधातु होता है जो ऋणायन (anion) बनाता है |
मैग्नीशियम क्लोराइड का सूत्र:
मैग्नीशियम क्लोराइड का सूत्र ज्ञात करने के लिए पहले हम धनायन का संकेत (Mg+) लिखते हैं इसके पश्चात् ऋणायन क्लोराइड (Cl–) लिखते हैं। तत्पश्चात् इनके आवेशों को आड़ा-तिरछा (criss-cross) करके हम सूत्र प्राप्त करते हैं।
उदाहरण 4:
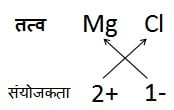
अत: सूत्र: MgCl2
उदाहरण 5:
ऐलुमिनियम ऑक्साइड का सूत्र:
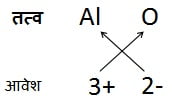
अत: सूत्र: Al2O3
बहुपरमाणुक आयनों वाले यौगिक:
उदाहरण 6:
सोडियम नाइट्रेट का सूत्र:
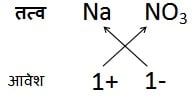
अत: सूत्र: NaNO3
उदाहरण 7:

अत: सूत्र: (NH4)2SO4
आण्विक द्रव्यमान (Molecular Mass):
किसी पदार्थ का आण्विक द्रव्यमान उसके सभी संघटक परमाणुओं के द्रव्यमानों का योग होता है। जैसे- जल (H2O) का आण्विक द्रव्यमान
हाइड्रोजन का परमाणु द्रव्यमान = 1 u
ऑक्सीजन का परमाणु द्रव्यमान = 16 u
जल के अणु में हाइड्रोजन के 2 अणु है और ऑक्सीजन के 1 अणु है
∴ जल का आण्विक द्रव्यमान = 2 x 1 + 16 = 18 u
इस प्रकार यह अणु का वह सापेक्ष द्रव्यमान है जिसे परमाणु द्रव्यमान इकाई (u) द्वारा व्यक्त किया जाता है।
सूत्र इकाई द्रव्यमान (Formula Unit Mass):
किसी पदार्थ का सूत्र इकाई द्रव्यमान उसके सभी संघटक परमाणुओं के परमाणु द्रव्यमानों का योग होता है। सूत्र द्रव्यमान का उपयोग तब करते हैं जब पदार्थ का संघटक आयन हों |
जैसे –
NaCl, CaCl2, Al2O3, MgCl2 आदि |
सूत्र द्रव्यमान का परिकलन उसी प्रकार से करते हैं जिस प्रकार से हमने आण्विक द्रव्यमान का परिकलन किया है। अंतर केवल इतना होता है कि यहाँ पर हम उस पदार्थ के लिए सूत्र इकाई का उपयोग करते हैं, जिसके संघटक आयन होते हैं।
किसी पदार्थ की मात्रा उसके द्रव्यमान से अथवा उसके परमाणुओं की संख्या से अभिलक्षित कर सकते हैं।
मोल (Mole):
मोल पदार्थ की वह मात्रा है जिसमें कणों की संख्या (परमाणु, आयन, अणु या सूत्र इकाई इत्यादि) कार्बन-12 के ठीक 12 g में विद्यमान परमाणुओं के बराबर होती है। वह मात्रा उस पदार्थ का एक मोल कहलाता है |
मोल एक प्रकार से बहुत सारे परमाणुओं का ढेर (heap) है | जिसमें’ किसी भी तत्व के परमाणुओं, अणुओं अथवा आयनों की संख्या 6.022 x 1023 होता है |
आवोगाद्रो संख्या आवोगाद्रो स्थिरांक: किसी पदार्थ के एक मोल में कणों (परमाणु, अणु अथवा आयन) की संख्या निश्चित होती है | जिसका मान 6.022 x 1023 होता है | इसी संख्या को आवोगाद्रो स्थिरांक या आवोगाद्रो संख्या कहते हैं |
जैसे –
तत्व के परमाणु | परमाणु द्रव्यमान (u) | मात्रा (g) में | मोलों की संख्या | परमाणुओं की संख्या |
हाइड्रोजन | 1 u | 1 g | 1 | 6.022 x 1023 |
कार्बन | 12 u | 12 g | 1 | 6.022 x 1023 |
नाइट्रोजन | 14 u | 14 g | 1 | 6.022 x 1023 |
ऑक्सीजन | 16 u | 16 g | 1 | 6.022 x 1023 |
सोडियम | 23 u | 23 g | 1 | 6.022 x 1023 |
तालिका को देखें और निम्न बातों को समझें:
— हाइड्रोजन का 1 g परमाणु में 1 मोल होता है और उस 1 मोल में परमाणुओं की संख्या 6.022 x 1023 होती है |
— कार्बन का 12 g परमाणु में 1 मोल होता है और उस 1 मोल में परमाणुओं की संख्या 6.022 x 1023 होती है |
— ऑक्सीजन के 16 g परमाणु में 1 मोल होता है और उस 1 मोल में ऑक्सीजन परमाणुओं की संख्या 6.022 x 1023 होती है |
इसी प्रकार आप सभी परमाणु का मोल ज्ञात कर सकते है और उसमें परमाणुओं की संख्या ज्ञात कर सकते हैं |
अब इसे समझे:
— हाइड्रोजन के 1 u में 1 परमाणु होता है |
— कार्बन के 12 u में भी 1 परमाणु होता है |
— नाइट्रोजन के 14 u में भी 1 परमाणु होता है |
— ऑक्सीजन के 16 u में भी 1 परमाणु होता है |
इसी प्रकार आप सभी तत्वों के परमाणुओं का भी ज्ञात कर सकते हैं |
मोलर द्रव्यमान (Molar mass):
किसी तत्व के परमाणुओं के एक मोल का द्रव्यमान को मोलर द्रव्यमान कहते है | परमाणुओं के मोलर द्रव्यमान को ग्राम परमाणु द्रव्यमान भी कहते हैं |
उदाहरण:
हाइड्रोजन के एक परमाणु का द्रव्यमान = 1 u
अत: हाइड्रोजन का ग्राम परमाणु द्रव्यमान = 1 g होगा, और 1 g हाइड्रोजन में हाइड्रोजन के 1 मोल परमाणु होते है और इस 1 मोल में हाइड्रोजन परमाणुओं की संख्या 6.022 x 1023 होता है |
इसी प्रकार कार्बन के 1 मोल का मोलर द्रव्यमान 12 g है |
ऑक्सीजन के 1 मोल का मोलर द्रव्यमान 16 g है |
सोडियम के 1 मोल का मोलर द्रव्यमान 23 g है |
इसी प्रकार:
1 u हाइड्रोजन में केवल 1 हाइड्रोजन परमाणु होता है |
4 u हीलियम में केवल 1 हीलियम परमाणु होता है |
12 u कार्बन में केवल 1 कार्बन परमाणु होता है |
We hope that class 9 Science Chapter 3 परमाणु एवं अणु (Pure Atoms and Molecules Pure) Notes in Hindi helped you. If you have any queries about class 9 Science Chapter 3 परमाणु एवं अणु (Pure Atoms and Molecules Pure) Notes in Hindi or about any other Notes of class 9 Science in Hindi, so you can comment below. We will reach you as soon as possible…