पाठ – 4
परमाणु की संरचना
In this post we have given the detailed notes of class 9 Science chapter 4 Pure Structure of The Atom Pure in Hindi. These notes are useful for the students who are going to appear in class 9 board exams.
इस पोस्ट में कक्षा 9 के विज्ञान के पाठ 4 परमाणु की संरचना के नोट्स दिये गए है। यह उन सभी विद्यार्थियों के लिए आवश्यक है जो इस वर्ष कक्षा 9 में है एवं विज्ञान विषय पढ़ रहे है।
| Board | CBSE Board, UP Board, JAC Board, Bihar Board, HBSE Board, UBSE Board, PSEB Board, RBSE Board, CGBSE Board, MPBSE Board |
| Textbook | NCERT |
| Class | Class 9 |
| Subject | Science |
| Chapter no. | Chapter 4 |
| Chapter Name | परमाणु की संरचना (Pure Structure of The Atom Pure) |
| Category | Class 9 Science Notes in Hindi |
| Medium | Hindi |
पाठ 4 परमाणु की संरचना
अवपरमाणुक कण
परमाणु (Atom): पदार्थ के सबसे सूक्ष्मतम एवं अविभाज्य कण को परमाणु कहते हैं| परमाणु के तीन अवपरमाणुक कण (subatomic particles) होते हैं|
(i) प्रोट्रॉन (Protron)
(ii) न्यूट्रॉन (Neutron)
(iii) इलेक्ट्रान (Electron)
परमाणु के अन्दर उपस्थित ये अवपरमाणुक कणों में से दो कण आवेशित होते हैं:
(i) प्रोट्रान (Protron): यह धन आवेशित (+) कण होता है जो परमाणु के नाभिक (भीतरी भाग) में रहता है| यह तत्व के सभी रासायनिक गुण धर्म को प्रदर्शित करता है| परमाणु में प्रोट्रान के घटने या बढ़ने से उसके रासायनिक गुणधर्म भी बदल जाते हैं|
- प्रोट्रॉन को p+ से दर्शाया जाता है|
- इनका द्रव्यमान इलेक्ट्रान k अपेक्षा लगभग 2000 गुणा अधिक होता है|
- प्रोट्रॉन का द्रव्यमान 1 इकाई और इसका आवेश +1 लिया जाता है|
- इन्हें असानी से नहीं निकाला जा सकता है क्योंकि ये नाभिक में रहते है यदि इन्हें निकाला गया तो नाभिक टूट जायेगा|
प्रोट्रॉन की खोज ई. गोल्डस्टीन ने किया था|
(ii) इलेक्ट्रान (Electron): परमाणु: यह ऋण आवेशित (-) कण है जो नाभिक के चारों ओर भिन्न-भिन्न और निश्चित कक्षाओं में चक्कर काटते हैं|
- इसे e– द्वारा दर्शाया जाता है|
- इलेक्ट्रान का द्रव्यमान नगण्य और आवेश -1 लिया जाता है|
- इलेक्ट्रॉन्स को आसानी से निकाला जा सकता है|
इलेक्ट्रान की खोज जे. जे. टॉमसन की थी|
(iii) न्यूट्रॉन (Neutron): न्यूट्रॉन परमाणु के नाभिक में उपस्थित बिना आवेश वाला कण है जिस पर कोई आवेश नहीं होता है|
न्यूट्रॉन की खोज:
1932 में जे. चैडविक ने एक और अवपरमाणुक कण को खोज निकाला, जो अनावेशित और द्रव्यमान में प्रोटाॅन के बराबर था। अंततः इसका नाम न्यूट्राॅन पड़ा।
- हाइड्रोजन को छोड़कर ये सभी परमाणुओं के नाभिक में होते हैं।
- समान्यतः, न्यूट्राॅन को ‘n’ से दर्शाया जाता है।
- परमाणु का द्रव्यमान नाभिक में उपस्थित प्रोटाॅन और न्यूट्रॉन के द्रव्यमान के योग के द्वारा प्रकट किया जाता है।
उदासीन परमाणु: समान्यत: कोई भी परमाणु उदासीन होता है क्योंकि परमाणु में धन प्रोट्रानो की संख्या ऋण इलेक्ट्रानों की संख्या के बराबर होता है यही कारण है कि किसी भी परमाणु पर नेट आवेश शून्य होता है और परमाणु उदासीन होते है|
जे. जे टॉमसन पहले वैज्ञानिक थे जिन्होंने परमाणु का मॉडल प्रस्तुत किया|
केनाल किरणें: केनाल किरणें विसर्जन नलिका के एनोड से निकलने वाले धन आवेशीत कणों की धारा है, जब बहुत ही कम दाब पर गैस में से विद्युत धारा प्रवाहित की जाती है।
उदासीन परमाणु: समान्यत: कोई भी परमाणु उदासीन होता है क्योंकि परमाणु में धन प्रोट्रानो की संख्या ऋण इलेक्ट्रानों की संख्या के बराबर होता है यही कारण है कि किसी भी परमाणु पर नेट आवेश शून्य होता है और परमाणु उदासीन होता है|
जैसे ऑक्सीजन (O) के परमाणु में 8 धन प्रोट्रान होते है उतनी ही ऋण इलेक्ट्रान होते है|
परमाणु मॉडल
टॉमसन का परमाणु मॉडल:
टॉमसन ने परमाणुओं की संरचना से संबंधित एक मॉडल प्रस्तुत किया, जो क्रिसमस केक की तरह था। इनके अनुसार परमाणु एक धनावेशित गोला था, जिसमें इलेक्ट्रॉन क्रिसमस केक में लगे सूखे मेवों की तरह थे।
तरबूज का उदाहरण भी ले सकते हैं|
जिसके अनुसार परमाणु में धन आवेश तरबूज के खाने वाले लाल भाग की तरह बिखरा है, जबकि इलेक्ट्रॅान धनावेशित गोले में तरबूज के बीज की भांति धंसे हैं|
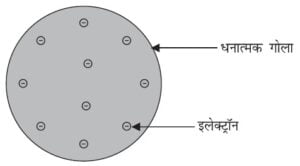
टॉमसन का परमाणु मॉडल
टॉमसन ने प्रस्तावित किया किः
(i) परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॅान उसमें धंसे होते हैं।
(ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
टॉमसन के परमाणु मॉडल की कमियाँ/सीमाएँ:
(i) दुसरे वैज्ञानिकों द्वारा किये गए प्रयोगों को इस मॉडल के द्वारा नहीं समझाया जा सका|
परमाणु नाभिक की खोज:
परमाणु केन्द्रक की खोज रदरफोर्ड ने की, उन्होने तेज गति से चल रहे अल्फा कणों को सोने की पतली पन्नी पर टकराया गया। जिसके परिणाम से पता चला कि परमाणु में अधिकांश भाग खाली है जहाँ से अल्फा कण बीना टकराये पन्नी से सीधे निकल गये परन्तु कुछ अल्फा कण पन्नी के द्वारा बहुत छोटे कोण से विक्षेपित हुए। जहाँ से ये कण विक्षेपित हुए थे, दरअसल वह परमाणु का नाभिक अर्थात केन्द्रक था। इस प्रकार रदरफोर्ड ने नाभिक की खोज की।
रदरफोर्ड के परमाणु प्रयोग के परिणाम:
अल्फ़ा कण-प्रकीर्णन प्रयोग ने आशा के बिलकुल विपरीत परिणाम दिया।
इससे निम्नलिखित परिणाम मिले –
(i) तेज गति से चल रहे अधिकतर अल्फ़ा कण सोने की पन्नी से सीधे निकल गए।
(ii) कुछ अल्फ़ा कण पन्नी के द्वारा बहुत छोटे कोण से विक्षेपित हुए।
(iii) आश्चर्यजनक रूप से प्रत्येक 12000 कणों में से एक कण वापस आ गया।
रदरफोर्ड के परमाणु नाभकीय मॉडल के लक्षण:
रदरफोर्ड के प्रयोगो के आधार पर परमाणु का नाभकीय – मॉडल के निम्नलिखित लक्षण थे।
- परमाणु का केन्द्र धन आवेशीत होता है जिसे नाभिक कहा जाता है।
- एक परमाणु का लगभग सम्पूर्ण द्रव्यमान नाभिक में होता है।
- इलेक्ट्रान नाभिक के चारो ओर निश्चित कक्षाओं में चक्कर लगाते है।
- नाभिक का आकार परमाणु की तुलना में काफी कम होता हैं।
- परमाणु में इलेक्ट्रॉन की संख्या मॉडल की संख्या के बराबर होता है।
रदरफोर्ड के परमाणु मॉडल:
रदरफोर्ड ने जो परमाणु मॉडल प्रस्तुत किया उसके अनुसार-
(i) परमाणु के भीतर का अधिकतर भाग खाली है क्योकि अधिकतर अल्फा कण बिना विक्षेपित हुए सोने की पन्नी से बाहर निकल जाते है।
(ii) बहुत कम कण अपने मार्ग से विक्षेपित होते है जिससे यह ज्ञात होता है कि परमाणु में धन आवेशित भाग बहुत कम होता है।
(iii) ये धन आवेशित भाग परमाणु का नाभिक होता है।
(iv) इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगाते है।
रदरफोर्ड के परमाणु मॉडल की सीमाएँ:
रदरफोर्ड के परमाणु मॉडल के अनुसार:
इलेक्ट्रॉन्स परमाणु के नाभिक के चारों ओर चक्कर लगाते है जैसे- ग्रह सूर्य के चारो ओर चक्कर लगाते है| परन्तु, इलेक्ट्रॉन वृतीय कक्षा में घुमते हुए स्थायी नहीं बने रहेंगे क्योंकि परिक्रमा के दौरान वे त्वरण उत्पन्न करते हैं| इस त्वरण के कारण वे विकिरण के रूप में ऊर्जा मुक्त करेंगे और वे नाभिक की खींचे चले जायेंगे और नाभिक से टकरायेंगे| ऐसी स्थिति में परमाणु अत्यधिक अस्थिर हो जायेगा और नष्ट हो जायेगा| जबकि ऐसी बात नहीं है|
नील्स बोर के परमाणु मॉडल:
नील्स बोर अपने परमाणु मॉडल की निम्न अवधारणाए प्रस्तुत कीं-
(i) इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते है, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते है।
(ii) जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते है तो उनकी उर्जा का विकिरण नहीं होता।
इलेक्ट्रॉनिक विन्यास और संयोजकता
ऊर्जा स्तर: परमाणु के नाभिक के चारों ओर इलेक्ट्रोनों के चक्कर लगाने के लिए विभिन एवं निश्चित कक्षाएँ होती हैं इन्हें कोश (Shell) भी कहते हैं इन्ही कक्षाओं को ऊर्जा स्तर कहते है|

किसी परमाणु में ऊर्जा स्तर
इलेक्ट्रोनिक विन्यास (Electronic Configuration): किसी परमाणु के विभिन्न कोशों में इलेक्ट्रोनों के वितरण को इलेक्ट्रोनिक विन्यास कहते हैं|
हाइड्रोजन का इलेक्ट्रॉनिक संरचना:

हाइड्रोजन में 1 इलेक्ट्रान होता है अत: इसके बाह्यतम कक्षा K में केवल एक ही इलेक्ट्रान रहता है|
कार्बन के परमाणु का इलेक्ट्रॉनिक संरचना:
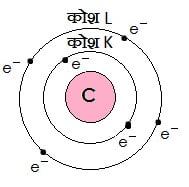
कार्बन के पास कुल 6 इलेक्ट्रॉन्स होते है तो इसके सबसे भीतरी कक्षा K में 2 इलेक्ट्रान रहता है और बहरी कक्षा L में शेष बचे 4 इलेक्ट्रॉन्स रहता है|
ये कोश होते हैं:
K, L, M, N आदि
कोश K में अधिकतम 2 इलेक्ट्रॉन्स रह सकते हैं|
कोश L में अधिकतम 8 इलेक्ट्रॉन्स रह सकते हैं|
कोश M में अधिकतम 18 इलेक्ट्रॉन्स रह सकते हैं और
कोश N में अधिकतम 32 इलेक्ट्रॉन्स रह सकते हैं|
कोशों में अधिकतम इलेक्ट्रॉन्स को रखने के लिए एक सूत्र है: 2n2
जिसके आधार अधिकतम इलेक्ट्रॉन्स की संख्या ज्ञात की जाती है:
जैसे पहले कोश K के लिए: 2(1)2 = 2 x 1 = 2
दुसरे कोश L के लिए: 2(2)2 = 2 x 4 = 8
तीसरे कोश M के लिए: 2(3)2 = 2 x 9 = 18
चौथे कोश N के लिए: 2(4)2 = 2 x 16 = 32
संयोकजता (valency):
किसी परमाणु के बाह्यतम कक्षा में उपस्थिति संयोजी इलेक्ट्रॉन्स की संख्या को उस तत्व की संयोजकता कहते हैं|
जैसे:
कुछ तत्वों का इलेक्ट्रॉनिक विन्यास और उनकी संयोजकता:
जैसे किसी तत्व के बाह्यतम कक्षा में 1 इलेक्ट्रॉन् है तो उसकी संयोजकता 1 ही होगी| यदि उसके बाह्यतम कक्षा में 2 , 3 या 4 है तो उसकी संयोजकता भी क्रमश: 2, 3 या 4 होगी| यदि बाह्यतम कोश में 5, 6 या 7 इलेक्ट्रॉन्स है तो संयोजकता निम्नानुसार ज्ञात किया जाता है|
जब बाह्यतम कोश में 5 हो तो संयोजकता = 8 – 5 = 3
जब बाह्यतम कोश में 6 हो तो संयोजकता = 8 – 6 = 2
जब बाह्यतम कोश में 7 हो तो संयोजकता = 8 – 7 = 1
जब बाह्यतम कोश में 8 हो तो संयोजकता = 8 – 8 = 0
अब यह तालिका देखिए:
तत्व का नाम | प्रतीक | परमाणु संख्या | प्रोट्रॉनों की संख्या | न्यूट्रॉनों की संख्या | इलेक्ट्रोनों की संख्या | इलेक्ट्रोनिक विन्यास K L M N | संयोजकता |
हाइड्रोजन | H | 1 | 1 | – | 1 | 1 | 1 |
हीलियम | He | 2 | 2 | 2 | 2 | 2 | 0 |
लिथियम | Li | 3 | 3 | 3 | 3 | 2 1 | 1 |
बेरिलियम | Be | 4 | 4 | 4 | 4 | 2 2 | 2 |
बोरान | B | 5 | 5 | 5 | 5 | 2 3 | 3 |
कार्बन | C | 6 | 6 | 6 | 6 | 2 4 | 4 |
नाइट्रोजन | N | 7 | 7 | 7 | 7 | 2 5 | 3 |
ऑक्सीजन | O | 8 | 8 | 8 | 8 | 2 6 | 2 |
फ्लोरीन | F | 9 | 9 | 9 | 9 | 2 7 | 1 |
नियाँन | Ne | 10 | 10 | 10 | 10 | 2 8 | 0 |
सोडियम | Na | 11 | 11 | 11 | 11 | 2 8 1 | 1 |
मैग्नेशियम | Mg | 12 | 12 | 12 | 12 | 2 8 2 | 2 |
एल्युमीनियम | Al | 13 | 13 | 13 | 13 | 2 8 3 | 3 |
सिलिकॉन | Si | 14 | 14 | 14 | 14 | 2 8 4 | 4 |
फोस्फोरस | P | 15 | 15 | 15 | 15 | 2 8 5 | 3, 5 |
सल्फर | S | 16 | 16 | 16 | 16 | 2 8 6 | 2 |
क्लोरीन | Cl | 17 | 17 | 17 | 17 | 2 8 7 | 1 |
आर्गन | Ar | 18 | 18 | 18 | 18 | 2 8 8 | 0 |
परमाणु संख्या: किसी परमाणु के नाभिक में उपस्थित प्रोट्रॉनों की कुल संख्या को परमाणु संख्या कहते है|
जैसे- मान लीजिये कि किसी परमाणु के नाभिक में कुल 8 प्रोट्रॉन है तो इसकी परमाणु की परमाणु संख्या 8 होगी| इसीप्रकार यदि कुल प्रोट्रॉन 11 है तो परमाणु संख्या भी 11 ही होगी|
परमाणु सख्या = प्रोट्रॉनों की सख्या
परमाणु द्रव्यमान: किसी परमाणु के नाभिक में उपस्थिति कुल प्रोट्रॉनों तथा न्यूट्रॉनों की संख्या के योगफल को परमाणु द्रव्यमान संख्या कहते हैं|
जैसे – किसी परमाणु के नाभिक में प्रोट्रॉनों की संख्या 4 है और न्यूट्रॉनों की संख्या 5 है तो इसका परमाणु द्रव्यमान संख्या 4 + 5 = 9 अर्थात 9 होगा|
इसी प्रकार किसी परमाणु के नाभिक में प्रोट्रॉनों की संख्या 7 है और न्यूट्रॉनों की संख्या भी 7 है तो इसका परमाणु द्रव्यमान संख्या 7 + 7 = 14 अर्थात 14 होगा|
अर्थात परमाणु द्रव्यमान संख्या = प्रोट्रॉनों की सख्या + न्यूट्रॉनों की संख्या
नोट: किसी भी परमाणु में जितने प्रोट्रॉनों की सख्या होती है उतनी ही इलेक्ट्रान की संख्या होती है और उतने ही उस तत्व की परमाणु संख्या भी होती है| न्यूट्रॉन की संख्या, प्रोट्रॉनों की सख्या के बराबर भी हो सकता है और कम भी या ज्यादा भी हो सकता है|
समस्थानिक एवं समभारिक
समस्थानिक:
समस्थानिक किसी तत्व के वे परमाणु होते है जिनकी परमाणु संख्या तो बराबर होती है परन्तु परमाणु द्रव्यमान भिन्न – भिन्न होता है। जैसे- हाइड्रोजन के तीन समस्थानिको के नाम है:
(i) प्रोटियम
(ii) ड्युटराँन
(iii) ट्राईटन
समस्थानिकों के अनुप्रयोग:
समस्थानिको के उपयोग हम विभिन्न क्षेत्रो में करते है।
- यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी में ईंधन के रूप में किया जाता है।
- कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग किया जाता है।
- घेंघा रोग के इलाज में आयोडिन के समस्थानिक का उपयोग किया जाता हैै।
समभारिक:
ऐसे परमाणु जिनकी द्रव्यमान संख्या समान परन्तु परमाणु संख्या भिन्न – भिन्न होती है।
जैसे– कैल्सियम के परमाणु संख्या 20 तथा आर्गन के परमाणु संख्या18 होती है जबकि दोनो तत्वो के परमाणु द्रव्यमान 40 है। अतः ये दोनों तत्व कैल्सियम तथा आॅर्गन समभारिक है। चूँकि इनका परमाणु संख्या अलग-अलग है परन्तु इनका द्रव्यमान एक सा है|
We hope that class 9 Science Chapter 4 परमाणु की संरचना (Pure Structure of The Atom Pure) Notes in Hindi helped you. If you have any queries about class 9 Science Chapter 4 परमाणु की संरचना (Pure Structure of The Atom Pure) Notes in Hindi or about any other Notes of class 9 Science in Hindi, so you can comment below. We will reach you as soon as possible…